Apolarimolekyylit
- 3569
- 540
- Gabriel Fahey
Se Apolarimolekyylit He ovat niitä, jotka esiintyvät rakenteessaan elektronien symmetrinen jakautuminen. Tämä on mahdollista, jos sen atomien elektronegatiivisuusero on pieni tai jos atomit tai elektronegatiiviset ryhmät peruuttavat niiden vaikutukset molekyyliin.
Ei aina "apolaarisuus" on ehdoton. Tästä syystä huonoja napaisuusmolekyylejä pidetään apolaarina; Eli sen dipolimomentti µ lähellä 0. Täällä syöt suhteellisen kentän: kuinka alhaisen µ: n tulisi olla niin, että molekyyliä tai yhdistettä pidetään apolaarina?
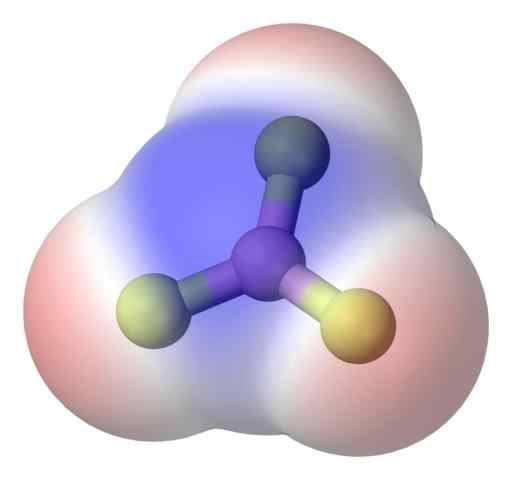
 BF3 -apolarimolekyyli. Lähde: Benjah-BMM27 kautta Commons Wikimedia.
BF3 -apolarimolekyyli. Lähde: Benjah-BMM27 kautta Commons Wikimedia. Aiheen ratkaisemiseksi paremmin sinulla on boori -trifluoridimolekyyli, BF3 (Yläkuva).
Fluoriatomi on paljon elektronegatiivisempi kuin Boro, ja siksi B-F-linkit ovat polaarisia. BF -molekyyli kuitenkin3 Se on symmetrinen (trigonaalinen taso) ja edellyttää kolmen B-F-hetken vektorin peruuttamista.
Siten syntyy myös apolaarisia molekyylejä, jopa polaaristen linkkien olemassaololla. Tuotettu napaisuus voidaan tasapainottaa toisen polaarisen linkin olemassaololla, jolla on sama suuruus kuin edellinen, mutta suunnattu vastakkaiseen suuntaan; kuten BF: ssä3.
Apolarimolekyylin ominaisuudet
Symmetria
Polaaristen linkkien vaikutuksista toistensa peruuttamiseen molekyylillä on oltava tietty geometrinen rakenne; Esimerkiksi lineaarinen, helpoin ymmärtää ensi silmäyksellä.
Näin on hiilidioksidi (Co2), jolla on kaksi polaarista linkkiä (o = c = o). Tämä johtuu siitä, että linkkien C = O kaksi dipolimomenttiä peruutetaan, kun yksi on suunnattu toiselle puolelle ja toinen kohti toista kohti, 180 °: n kulmassa.
Voi palvella sinua: transaminointiSiksi yksi ensimmäisistä ominaisuuksista, jotka otetaan huomioon, kun molekyylin ”apolaarisuus” arvioidaan lintulennolla, on tarkkailla kuinka symmetrinen se on.
Oletetaan, että CO: n sijasta2 Sinulla on molekyyli cos (o = c = s), nimeltään karbonyylisulfidi.
Nyt se ei ole enää apolaarinen molekyyli, koska rikkielektronegatiivisuus on pienempi kuin happi; Ja siksi dipolimomentti c = s on erilainen kuin c = o. Seurauksena on, että COS on polaarinen molekyyli (polaari on toisen säkin jauhot).
Alemmassa kuvassa on graafisesti yhteenveto kaikesta äskettäin kuvattu:
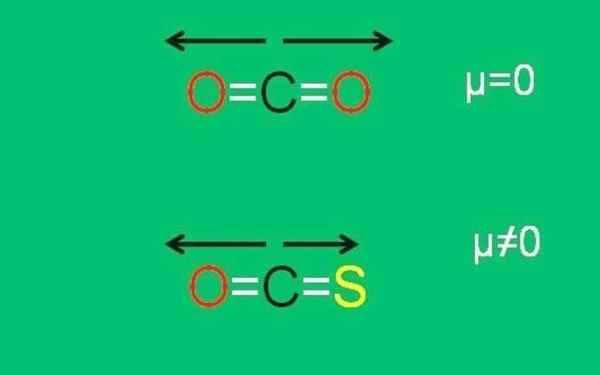 CO2- ja COS -molekyylien xxx -dipolaariset hetket. Lähde: Gabriel Bolívar.
CO2- ja COS -molekyylien xxx -dipolaariset hetket. Lähde: Gabriel Bolívar. Huomaa, että linkin c = s dipolimomentti on pienempi kuin linkki c = o COS -molekyylissä.
Elektronegatiivisuus
Elektronegatiivisuus Pauling -asteikolla on arvot välillä 0,65 (francio) ja 4,0 (fluori). Yleensä halogeenit ovat korkea elektronegatiivisuus.
Kun ero kovalenttisen sidoksen muodostavien elementtien elektronegatiivisuudessa on alle 0,4, sanotaan, että se on apolaarinen tai ei polaarinen. Ainoat todella apolaariset molekyyli.
Molekyylien väliset voimat
Jotta aine liukene veteen, sen on oltava vuorovaikutuksessa sähköstaatisesti molekyylien kanssa; vuorovaikutukset, jotka eivät pysty suorittamaan apolaarisia molekyylejä.
Apolarimolekyyleissä niiden sähkövaraukset eivät ole rajoittuneet molekyylin toiseen päähän, vaan symmetrisesti jakautuneet (tai homogeenisesti). Siksi hän ei pysty vuorovaikutukseen dipoli-dipolovoimien kautta.
Voi palvella sinua: AtomitilaSen sijaan apolaariset molekyylit ovat vuorovaikutuksessa keskenään Lontoon dispersiovoimien kautta; Nämä ovat välittömiä dipoleja, jotka polarisoivat naapurimolekyylien atomien elektronisen pilven. Tässä molekyylimassa on hallitseva tekijä näiden molekyylien fysikaalisissa ominaisuuksissa.
Kuinka tunnistaa apolaariset molekyylit?
-Ehkä yksi parhaat menetelmät apolaarisen molekyylin tunnistamiseksi on sen liukoisuus eri polaarisiin liuottimiin, jotka ovat yleensä vähän liukenevia niihin.
-Yleensä apolaariset molekyylit ovat kaasumaisia. Ne voivat myös olla sekoittumattomia nesteitä vedellä.
-Apolaariset kiinteät aineet on ominaista pehmeäksi.
-Dispersiovoimat, jotka pitävät ne yhdessä yhdessä, ovat yleensä heikkoja. Tämän vuoksi sen sulamis- tai kiehumispisteet ovat yleensä alhaisemmat kuin napayhdisteet.
-Apolaariset molekyylit, etenkin nestemäisessä muodossa, ovat huonoja sähkönjohtimia, koska niistä puuttuu sähkövaraus.
Esimerkkejä apolarimolekyyleistä
jalokaasut
Vaikka ne eivät ole molekyylejä, jalokaasuja pidetään apolaarina. Jos oletetaan, että kaksi sen atomista on vuorovaikutuksessa lyhyen ajanjakson ajan, tätä vuorovaikutusta voidaan pitää (puoli) molekyylinä; molekyyli, joka olisi apolaarinen luonne.
Diatomiset molekyylit
Diatomiset molekyylit, kuten h2, br2, minä2, Cl2, o2, ja f2, Ne ovat apolaarisia. Nämä ovat yleensä2, A-a.
Hiilivety
Entä jos se olisi atomien ryhmä? Se olisi ennen muita apolaarisia yhdisteitä; Esimerkiksi etaani, cho3-CH3, jonka hiiliranko on lineaarinen, c-c.
Metano, ch4, ja etaani, c2H6, Ne ovat apolaarisia molekyylejä. Hiilen elektronegatiivisuus on 2,55; Kun taas vety elektronegatiivisuus on 2,2. Siksi vedystä hiileen suuntautuneen dipolivektori on matala intensiivinen dipolivektori.
Se voi palvella sinua: Mohr -menetelmä: Perusteet, reaktiot, menettely, käyttöMutta metaanien ja etaanimolekyylien geometrisen symmetrian vuoksi dipolivektoreiden tai dipolimomenttien summa molekyyleissä on tyhjyyttä, joten molekyyleissä ei ole nettokuormaa.
Yleensä sama asia tapahtuu kaikilla hiilivetyillä, ja jopa silloin, kun niissä on tyydyttymistä (kaksois- ja kolminkertaiset sidokset), niitä pidetään apolaarina tai alhaisen polaarisuuden yhdisteinä. Myös sykliset hiilivedyt ovat apolaarisia molekyylejä, kuten sykloheksania tai syklobutaania.
Toiset
Hiilidioksidimolekyylit (CO2) ja hiilidisulfidi (CS2) Ne ovat apolaarisia molekyylejä, molemmat lineaarisella geometrialla.
Hiilidisulfidissa hiilielektronegatiivisuus on 2,55, kun taas rikkielektronegatiivisuus on 2,58; Joten molemmilla elementeillä on käytännössä sama elektronegatiivisuus. Dipolivektoria ei ole syntynyt, ja siksi nettokuorma on nolla.
Myös seuraavia CCL -molekyylejä on saatavana4 ja Albr3, Molemmat apolar:
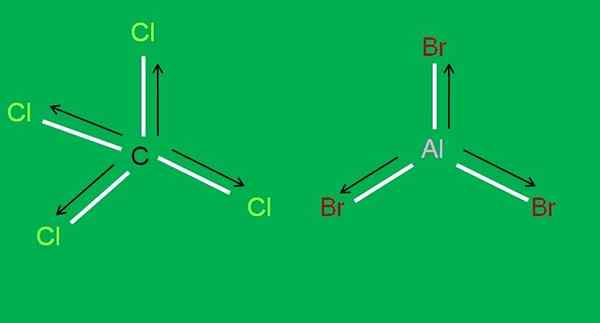 CCL4- ja Albr3 -molekyylit. Lähde: Gabriel Bolívar.
CCL4- ja Albr3 -molekyylit. Lähde: Gabriel Bolívar. Alumiinitribromidissa, Albb3 Sama asia tapahtuu BF: n kanssa3, Artikkelin alussa. Samaan aikaan hiilitetrakloridille, CCL4, Geometria on tetraedrinen ja symmetrinen, koska kaikki C-CL-linkit ovat yhtä suuret.
Samoin molekyylit yleisen kaavan kanssa CX4 (Vrt4, CI4 ja cbr4), ne ovat myös apolaarisia.
Ja lopuksi, apolaarisella molekyylillä voi olla jopa oktaedrinen geometria, kuten rikeheksafluoridilla, SF: llä6. Itse asiassa sinulla voi olla minkä tahansa geometrian tai rakenteen, kunhan se on symmetrinen ja sen elektroninen jakauma on homogeeninen.
Viitteet
- Polaarinen molekyyli. Palautettu: kemia.Ohjaaja.com
- Esimerkki polaarisista ja ei -polaarisista molekyyleistä. Toipunut: Admingco.com
- « Aineen tasapaino, yleinen yhtälö, tyypit
- Daniel Servitje Montull Biography, johtajuus ja panokset »

