Aineen tasapaino, yleinen yhtälö, tyypit
- 868
- 241
- Dr. Travis Reichert
Hän aineellinen tasapaino Komponenttien lukumäärä kuuluu tutkittavaan järjestelmään tai prosessiin. Tätä tasapainoa voidaan soveltaa melkein minkä tahansa tyyppiseen järjestelmään, koska oletetaan, että tällaisten elementtien massojen summan on pysyttävä vakiona mittausten eri mittauksiin.
Voit ymmärtää komponentin avulla marmoreille, bakteereille, eläimille, puulle, kakun ainesosille; ja kemian, molekyylien tai ionien tai tarkemmin sanottujen yhdisteiden tai aineiden tapauksessa. Sitten järjestelmää tulevien molekyylien kokonaismassan, kemiallisen reaktion kanssa tai ilman sitä, on pysyttävä vakiona; niin kauan kuin vuototappioita ei ole.
Käytännössä esitetään lukemattomia ongelmia, jotka voivat vaikuttaa aineen tasapainoon, sen lisäksi, että otetaan huomioon aineen erilaiset ilmiöt ja monien muuttujien vaikutukset (lämpötila, paine, virtaus, levottomuus, reaktorin koko jne.-A.
Paperilla asian saldon laskelmien on kuitenkin osuttava; Eli kemiallisten yhdisteiden massa ei saisi kadota milloin tahansa. Tämän tasapainon tekeminen on analoginen, jotta kivi on kasa tasapainossa. Jos jokin massoista pääsee paikoilleen, kaikki hajoaa; Tässä tapauksessa se tarkoittaisi, että laskelmat ovat vääriä.
Yleinen kohteen tasapainoyhtälö
Jokaisessa järjestelmässä tai prosessissa on ensin määritettävä, mitkä heidän rajansa ovat. Heiltä tiedetään, mihin yhdisteet tulevat tai lähtevät. On kätevää tehdä niin varsinkin jos on otettava huomioon useita prosessiyksiköitä. Kun kaikki yksiköt tai osajärjestelmät otetaan huomioon, keskustellaan yleisistä aineista.
Tällä saldolla on yhtälö, jota voidaan soveltaa mihin tahansa järjestelmään, joka noudattaa massan säilyttämistä koskevaa lakia. Yhtälö on seuraava:
Voi palvella sinua: Lyijykloridi: Ominaisuudet, rakenne, käyttötarkoituksetE + g - s - c = a
Missä E on sen aineen määrä tulla Järjestelmään; G on mitä tiedän Tuottaa jos prosessissa tapahtuu kemiallinen reaktio (kuten reaktorissa); S on mitä tulee ulos järjestelmän; C on mitä tiedän kuluttaa, Jälleen, jos reaktio on; Ja lopuksi, se on mitä tiedän kertyä.
Yksinkertaistaminen
Jos tutkittussa järjestelmässä tai prosessissa ei ole kemiallista reaktiota, G ja C ovat nollan arvoisia. Siten yhtälö säilyy:
E - s = a
Jos järjestelmää otetaan huomioon myös paikallaan olevassa tilassa, ilman merkittäviä muutoksia komponenttien muuttujissa tai virtauksissa, sanotaan. Siksi se on nollan arvoinen, ja yhtälö lopulta yksinkertaistaa vielä enemmän:
E = s
Toisin sanoen tulevan aineen määrä on yhtä suuri kuin se, joka tulee ulos. Mikään ei voi kadota tai kadota.
Toisaalta, jos on olemassa kemiallinen reaktio, mutta järjestelmä on paikallaan olevassa tilassa, G: llä ja C: llä on arvoja ja ne ovat edelleen nolla:
E + G - S - C = 0
E + g = s + c
Tarkoittaen, että reaktorissa tulevien reagenssien massa ja siinä tuottavat tuotteet ovat yhtä suuret kuin esiin tulevien tuotteiden ja reagenssien massa ja kulutettujen reagenssien massa.
Esimerkki sen käytöstä: Kalat joessa
Oletetaan, että tutkitaan joessa olevien kalojen lukumäärää, jonka pankit tulevat edustamaan järjestelmän rajaa. On tiedossa, että keskimäärin 568 kalaa tulee vuodessa, 424 syntyy (tuottaa), 353 kuole (kuluttaa) ja 236 muuttaa tai lähteä.
Yleisen yhtälön soveltaminen sitten:
568 + 424 - 353 - 236 = 403
Tämä tarkoittaa, että 403 kalalle ne kerääntyvät jokeen; eli vuodessa joki rikastuttaa enemmän kaloja. Jos minulla olisi negatiivinen arvo, se tarkoittaisi, että kalojen lukumäärä vähenee, ehkä negatiivisiin ympäristövaikutuksiin.
Se voi palvella sinua: ioninen voima: Yksiköt, kuinka se lasketaan, esimerkkejäKaverit
Yleisen yhtälön perusteella voit ajatella, että erityyppisille kemiallisille prosesseille on neljä yhtälöä. Ainetasapaino on kuitenkin jaettu kahteen tyyppiin toisen kriteerin mukaan: aika.
Differentiaalinen tasapaino
Eroaineiden tasapainossa on komponenttien määrä järjestelmässä tietyllä hetkellä tai ajankohtana. Nämä massamäärät ilmaistaan aikayksiköillä, ja siksi ne edustavat nopeuksia; Esimerkiksi kg/h, mikä osoittaa kuinka monta kilometriä tulee, lähde, kerää, tuottaa tai kuluttaa tunnissa.
Jotta siellä on massaa (tai tilavuusvirtoja käsillä olevan tiheyden ollessa), järjestelmän on yleensä oltava auki.
Kiinteä tasapaino
Kun järjestelmä on suljettu, kuten ajoittaisissa reaktoreissa suoritetuissa reaktioissa (erätyyppi), sen komponenttien massat yleensä kiinnostuksena ennen prosessia ja sen jälkeen; eli alkuperäisten ja viimeisten T -aikojen joukossa.
Siksi määrät ilmaistaan pelkkinä massoina eikä nopeuksissa. Tämän tyyppinen tasapaino tehdään henkisesti, kun tehosekoitin käytetään: pääsyn aineosien massan on oltava yhtä suuri kuin moottorin jälkeen jäljellä oleva.
Esimerkkiharjoittelu
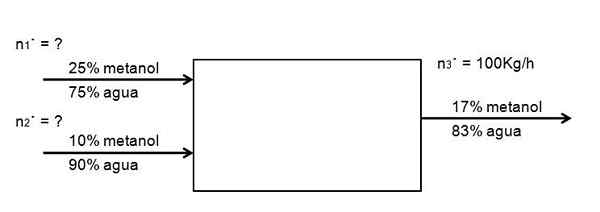
Vedessä on haluta laimentaa 25 -prosenttinen metanoliliuoksen virtaus, jolloin toinen 10 -prosenttinen pitoisuus on laimennettu, siten, että 100 kg/h syntyy 17 -prosenttisesta metanoliliuoksesta. Kuinka suuren osan molemmista metanoliliuoksista on 25 ja 10%, on siirryttävä järjestelmään tunnissa tämän saavuttamiseksi? Oletetaan, että järjestelmä on paikallaan olevassa tilassa
Voi palvella sinua: saponifikaatioSeuraava kaavio on esimerkki lausunnosta:
 Virtauskaavio metanoliliuoksen laimentamisen laimentamiseksi. Lähde: Gabriel Bolívar.
Virtauskaavio metanoliliuoksen laimentamisen laimentamiseksi. Lähde: Gabriel Bolívar. Kemiallista reaktiota ei ole, joten metanolin määrän, joka tulee sisään, on oltava yhtä suuri kuin ilmestyvä:
JAMetanoli = SMetanoli
0,25 N1· + 0,10 n2· = 0,17 N3·
Vain n arvo tunnetaan3·. Loput ovat tuntemattomia. Tämän kahden tuntemattoman yhtälön ratkaisemiseksi tarvitaan toinen tasapaino: veden tasapaino. Sitten saman tasapainon tekeminen vedelle on:
0,75 n1· + 0,90 N2· = 0,83 N3·
N: n arvo puhdistetaan veteen1· (Se voi olla myös n2·)
n1· = (83 kg/h - 0,90N2·)/ (0,75)
Korvaaminen sitten n1· Metanolin asiasta tasapainoyhtälössä ja N: n ratkaiseminen2· Sinulla on:
0,25 [(83 kg/h - 0,90N2·)/ (0,75)] + 0,10 N2· = 0,17 (100 kg/h)
n2· = 53,33 kg/h
Ja saada n1· Vähennä vain:
n1· = (100-53,33) kg/h
= 46,67 kg/h
Siksi tunnissa sinun on siirryttävä 46,67 kg: n metanoliliuoksen 46,67 kg ja 53,33 kg 10%: n liuoksesta 53,33 kg.
Viitteet
- Ryhmä ja Rousseau. (2000). Kemiallisten prosessien perusperiaatteet. (Toinen painos.-A. Addison Wesley.
- Fernández Germán. (20. lokakuuta 2012). Määritelmä aineen tasapaino. Toipunut: Teollisuus.netto

