Dipolaarinen momentti kuinka se lasketaan ja esimerkkejä

- 2446
- 252
- Edgar VonRueden
Hän Dipolaarinen hetki Se on kemiallinen ominaisuus, joka osoittaa, kuinka heterogeenisesti sähköiset varaukset jakautuvat molekyyliin. Se ilmaistaan Debye -yksiköissä, 3,33,10-30 C · m, ja yleensä niiden arvot vaihtelevat välillä 0 - 11 vuorokautta.
Erittäin polaarisilla yhdisteillä on yleensä suuria dipolimomentteja; kun taas apolaarinen, pienet dipolimomentit. Mitä polarisoituneempia sähkövaraukset ovat molekyylissä, sitä suurempi sen dipolimomentti; toisin sanoen on oltava alue, jossa on runsaasti elektroneja, Δ- ja toinen köyhä elektroneissa, δ+.
 Kaksivärinen luonnos toimii analogiana kahdelle molekyylille positiiviselle ja negatiiviselle pylväällä, jolla on merkitty dipolimomentti. Lähde: Pexels.
Kaksivärinen luonnos toimii analogiana kahdelle molekyylille positiiviselle ja negatiiviselle pylväällä, jolla on merkitty dipolimomentti. Lähde: Pexels. Dipolimomentti, μ, on vektorin suuruus, joten linkkien kulmat ja yleensä molekyylirakenne vaikuttaa siihen.
Kun molekyyli on lineaarinen, sitä voidaan verrata kahdenväriseen luonnokseen. Sen negatiivinen pää Δ-, se vastaa punaista väriä; Vaikka positiivinen, Δ+olisi sininen väri. Kun negatiivisten kuormitusten suuruus kasvaa Δ-navalla ja etäisyys, joka erottaa sen Δ+: sta, dipolimomentti kasvaa.
Kemiallisesti yllä oleva tarkoittaa, että mitä suurempi eroa elektronegatiivisuudessa kahden atomin välillä ja mitä pidempi etäisyys, joka erottaa ne, sitä suurempi dipolimomentti niiden välillä.
[TOC]
Kuinka dipolimomentti lasketaan?
Sitä pidetään kovalenttisena yhteytenä kahden atomin, a ja b välillä:
A-B
Positiivisen ja negatiivisen osittaisen kuorman välinen etäisyys on jo määritelty sen linkin pituudella:
-LlaΔ+-B -Δ-
Koska protoneilla ja elektronilla on sama sähkövaraus, mutta vastakkaisilla merkkeillä, 1.6 · 10-19C, tämä otetaan huomioon arvioitaessa dipolimomentin A: n ja B: n välillä seuraavan yhtälön kautta:
Se voi palvella sinua: erot orgaanisten ja epäorgaanisten yhdisteiden välilläμ = Δ ·d -d
Missä μ on dipolimomentti, δ on elektronin kuorma ilman negatiivista merkkiä, ja d -d Metreinä ilmaistun linkin pituus. Esimerkiksi olettaen, että d -d Sen arvo on 2 Å (1,10-10m) Dipolimomentti, μA-B on:
μA-B = (1.6 · 10-19C) · (2 · 10-10m)
= 3,2 · 10-29C · m
Mutta koska tämä arvo on hyvin pieni, käytetään Deby -yksikköä:
μ = (3,2 · 10-29C · m) · (1 d/3,33 · 10-30 C · m)
= 9,60 d
Tämä μA-B-arvo voisi olettaa, että A-B-linkki on ionisempi kuin kovalenttinen.
Esimerkit
Vettä
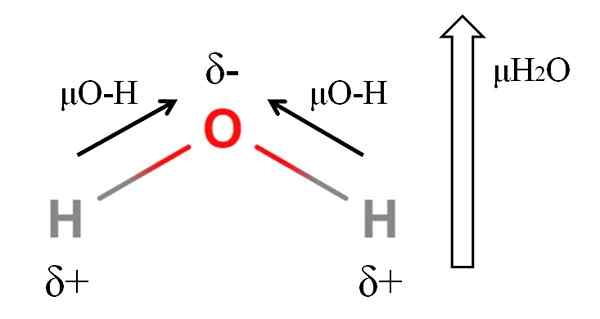 Vesimolekyylin dipoarinen hetki. Lähde: Gabriel Bolívar.
Vesimolekyylin dipoarinen hetki. Lähde: Gabriel Bolívar. Molekyylin dipolimomentin laskemiseksi sinun on lisättävä kaikki niiden linkkien dipolimomentit ottaen huomioon linkkien kulmat ja vähän trigonometria. Tämä aluksi.
Vesillä on yksi suurimmista dipolimomenteista, joita voidaan odottaa kovalenttiselle yhdisteelle. Yläkuvassa meillä on, että vetyatomeilla on positiivisia osittaisia kuormia, Δ+, kun taas happea kantaa negatiivisen osittaisen kuorman, δ-. O-H-linkki on melko polaarinen (1.5d), ja heistä on kaksi H -molekyylissä2JOMPIKUMPI.
Yleisesti. Vaikka niitä ei vedetä, happiatomilla on kaksi paria, jotka eivät ole jaettuja elektroneja, jotka "keskittyvät" negatiiviseen alueeseen vielä enemmän.
H: n kulmageometrian takia2Tai dipolimomentit liittyvät happiatomin suuntaan. Huomaa, että kahden μO-H: n summa antaisi 3D: tä (1.5+1.5); Mutta se ei ole niin. Veden dipolimomentin kokeellinen arvo on 1.85d. Tässä on 105º: n läheisen kulman vaikutus H-O-H-linkkien välillä.
Se voi palvella sinua: laboratoriolämpömittari: Ominaisuudet, mitä se on, käytä, esimerkkejäMetanoli
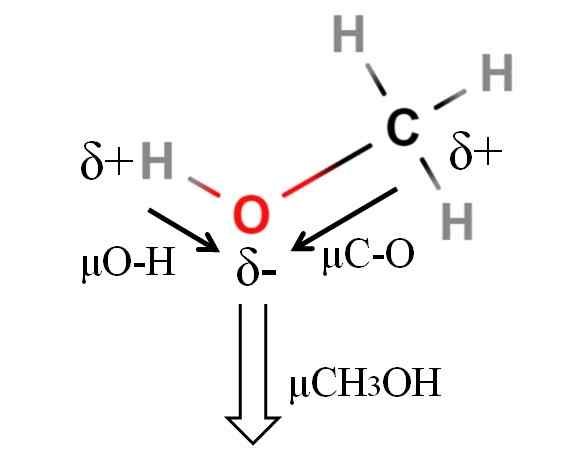 Metanolimolekyylin dipoarimomentti. Lähde: Gabriel Bolívar.
Metanolimolekyylin dipoarimomentti. Lähde: Gabriel Bolívar. Metanolin dipolimomentti on 1.69d. On vähemmän kuin vesi. Siksi atomimassoilla ei ole liikaa vaikutusta dipolin hetkessä; Mutta hänen atomiradiot. Metanolin tapauksessa emme voi vahvistaa, että H-O-linkissäsi on μ yhtä suuri kuin 1.5 D; koska molekyyliympäristöt ovat erilaisia CHO: ssa3Oi ja h2JOMPIKUMPI.
Siksi meidän on mitattava metanolissa olevan H-O. Mitä voidaan vahvistaa, on, että μO-H on suurempi kuin μC-O.
Metanoli on luetteloitu yhdeksi polaarisimmista liuottimista, joita löytyy yhdessä veden ja ammoniakin kanssa.
Ammoniakki
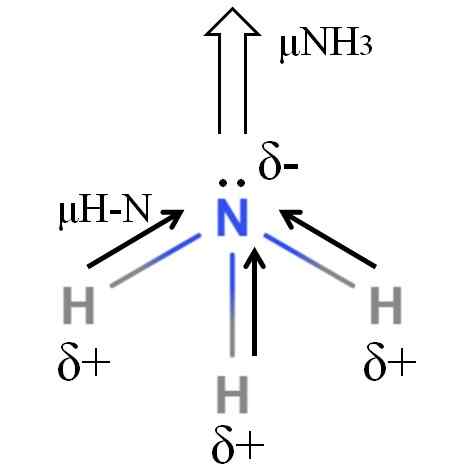 Ammoniakkimolekyylin dipoarimomentti. Lähde: Gabriel Bolívar.
Ammoniakkimolekyylin dipoarimomentti. Lähde: Gabriel Bolívar. H-N-sidokset ovat melko polaarisia, joten typpi sen suuremman elektronegatiivisuuden jälkeen houkuttelee elektroneja itseään (ylivoimainen kuva). Tämän lisäksi hänellä on pari sivuttaista elektronia, jotka lisäävät heidän negatiivisia kuormituksiaan Δ -alueelle-. Siksi sähkövaraukset ovat vallitsevia ammoniakin typpiatomista.
Ammoniakin dipolimomentti on 1.42d, vähemmän kuin metanolin. Jos sekä ammoniakki että metanoli voitaisiin muuttaa luonnoksiksi, nähdään, että metanolin luonnoksella on määriteltyjä pylväitä verrattuna ammoniakkiluonnokseen.
Etanoli
Etanolin tapauksessa CHO3CH2Voi dipolisi hetki on hyvin lähellä metanolia, mutta sillä on yleensä alhaisemmat arvot. A+.
Voi palvella sinua: dimetyyliamiini ((CH3) 2NH): rakenne, ominaisuudet, käyttö, riskitHiilidioksidi
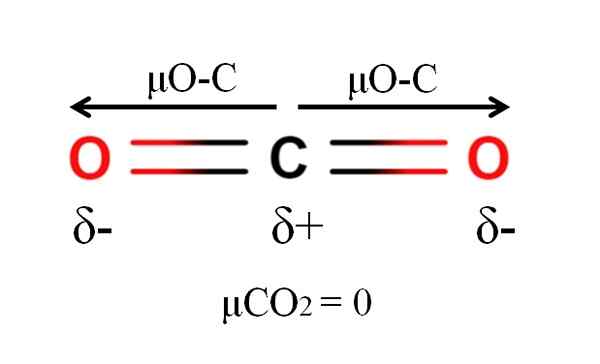 Hiilidioksidimolekyylin dipoarimomentti. Lähde: Gabriel Bolívar.
Hiilidioksidimolekyylin dipoarimomentti. Lähde: Gabriel Bolívar. Hiilidioksidilla on kaksi polaarista sidosta, c = o, vastaavilla dipolimomenteilla μO-C. Kuten ylemmässä kuvassa voidaan nähdä, CO: n lineaarinen geometria2 Tekee kaksi μO-C: n peruuttamaan toisiaan vektorisesti, vaikka hiilellä olisi positiivinen osittainen kuorma ja happea negatiiviset osittaiset kuormat.
Tästä syystä hiilidioksidi on apolaarinen molekyyli, koska μCO2 on arvo 0d.
Metaani
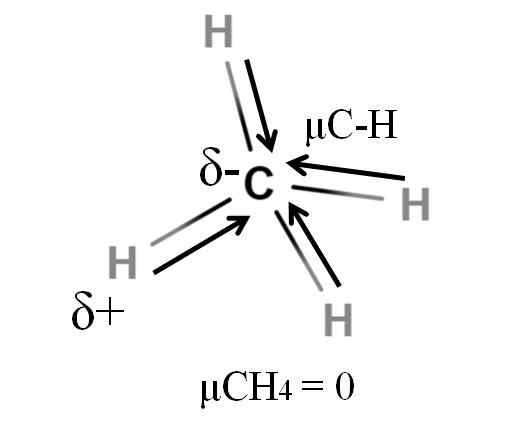 Dipolaarinen hetki metaanimolekyylille. Lähde: Gabriel Bolívar.
Dipolaarinen hetki metaanimolekyylille. Lähde: Gabriel Bolívar. Sekä metaani että hiilidioksidi jakavat jotain yhteistä: ne ovat erittäin symmetrisiä molekyylejä. Yleensä, mitä symmetrisempi molekyyli, sitä vähemmän sen dipolimomentti on.
Jos näemme CHO: n molekyylin4, Sen C-H-sidokset ovat polaarisia, ja elektronit on suunnattu kohti hiiliatomia, koska ne ovat hieman elektronegatiivisempia. Voidaan ajatella, että hiilen on oltava erittäin negatiivinen Δ -alue; Luonnoksena voimakkaalla punaisella keskuksella ja sinertävällä päillä.
Kuitenkin kun CHO on jaettu4 Puolissa saamme kaksi H-C-H-puolikkaata, yksi vasemmalla ja toisella oikealla, samanlainen kuin molekyyli H2JOMPIKUMPI. Siten näiden kahden μC-H: n lisäämisestä johtuva dipolimomentti peruutetaan toisen puolen momenttiin. Ja siksi μch4 on arvo 0d.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Walter J. Moore. (1963). Fysikaalinen kemia. Kemiallisessa kinetiikassa. Neljäs painos, Longmans.
- Iranin. Levine. (2009). Fysikaalis -periaatteet. Kuudes painos, sivu 479-540. MC Graw Hill.
- Helmestine, Anne Marie, PH.D -d. (29. tammikuuta 2020). Dipolimemääritelmä. Toipunut: Admingco.com
- Blaber Mike. (29. syyskuuta 2019). Dipolimomentit. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Larita Williams. (2020). Dipolimomentti: Määritelmä, yhtälö ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- Wikipedia. (2020). Bond Dipolin hetki. Haettu: vuonna.Wikipedia.org
- « Kaasuvalaistus kuinka havaita se ja 5 vinkkiä sen välttämiseksi
- Onomatopoeia -ominaisuudet, toiminto, tyypit, esimerkit »

