Bradford -menetelmä Mikä on, periaate, reagenssit, käyttää

- 874
- 34
- Kelly Kilback
Hän Bradford -menetelmä Se on kolorimetrinen menetelmä, jota käytetään tällä hetkellä kokonaisproteiinikonsentraation nopeaan arviointiin biologisissa kokeilunäytteissä. Sitä käytetään lukuisissa biologisen, lääketieteellisen, eläinlääketieteellisen, agronomisen tutkimuksen jne. Aloissa.
Se tunnetaan nimellä "Bradford Method", koska Marion Bradford kuvasi sen ensimmäisen kerran vuonna 1976 sen julkaisussa Nopea ja herkkä menetelmä proteiinien kvantifioimiseksi mikrogrammien määrissä käyttämällä proteiini-youth-liiton periaatetta.
 Valokuva ELISA-plakista, jossa näytteet ovat valmistaneet Bradfordin kvantifiointiin (lähde: Helito, CC BY-SA 4.0, Wikimedia Commons) kautta)
Valokuva ELISA-plakista, jossa näytteet ovat valmistaneet Bradfordin kvantifiointiin (lähde: Helito, CC BY-SA 4.0, Wikimedia Commons) kautta) Ehdotuksensa jälkeen tätä menetelmää on suosittu suosituksi, koska se tunnustetaan herkempi kuin muut proteiinin kvantifiointimenetelmät (kuten esimerkiksi Lowry ja Biuret); vakaampi monimutkainen muoto ja on taloudellista ja helppo suorittaa.
Lisäksi on osoitettu, että heidän käyttämillä reagensseilla on hyvin vähän häiriöitä spektrofotometrisissä mittauksissa eri olosuhteissa.
[TOC]
Menetelmäperiaate
Bradfordin menetelmä perustuu näytteen proteiinimolekyylien liuoksen värimuutosten kvantifiointiin liuoksessa - happamissa olosuhteissa - erityisen väriaineen molekyylien kanssa: Coomassie Blue Loistava sininen G250.
Kun tätä väriainetta lisätään proteiiniliuokseen, se sitoutuu näihin molekyyleihin sähköstaattisten voimien kautta ja tämä reaktio näkyy punertavan ruskean värin muuttuessa siniseksi siniseksi.
Proteiinit ja aminohapot
Aivan kuten kehon muodostuvat monet solut ja nukleiinihappo (kuten DNA ja RNA) muodostuu nukleotideilla, proteiinit muodostuvat joidenkin aminohappojen tunnetuista molekyyleistä järjestetyillä sekvensseillä.
Aminohappo on molekyyli, joka koostuu keskushiiliatomista, johon on liitetty 4 erilaista kemiallista ryhmää: vetyatomi, karboksyyliryhmä, aminoharja ja ryhmä tai sivuketju, joka antaa identiteetin.
Kaikille proteiineille on 20 aminohappoa, jotka eroavat toisistaan heidän sivuryhmien ominaisuuksien suhteen: on emäksisiä aminohappoja, happoja, polaarisia, apolaarisia, syklisiä, aromaattisia jne.
Voi palvella sinua: Shelfordin suvaitsevaisuuslaki: Mikä on ja esimerkkejäNäiden aminohappojen ominaisuuksien summa ja järjestys, jossa ne liittyvät proteiinirakenteen muodostamiseksi, antaa jokaiselle proteiinille sarjan erityisiä fysikaalis -kemiallisia ominaisuuksia riippumatta.
Sävyproteiinikompleksi
Bradfordin menetelmä kvantifioi sitten emäksisten ominaisuuksien aminohappotähteiden esiintymisen biologisissa näytteissä, erityisesti aminohapoissa, kuten arginiini, lysiini ja histidiini, jotka ovat helpommin mukautettuja Coomassie -sinisellä.
Värimuutokset kvantifioidaan näytteiden absorbanssin variaatioiksi, jotka mitataan käyttämällä spektrofotometriä, joka on säädetty 595 nm: n aallonpituuteen.
Mikä on absorbanssi?
Sitä kutsutaan myös optiseksi tiheydeksi ja määrittelee liuoksen absorboivan valon määrän. Tämä absorptio riippuu liuoksen säteilytyksestä käytetyn valon aallonpituudesta, koska kaikki molekyylit eivät kykene absorboimaan samaa aallonpituutta.
Tämä ilmiö tiivistettiin olut-Lambertin laki, joka luodaan olut-Lambertin laki, joka luo suhteen aineen läpi kulkevan valon määrän ja mainitun aineen ominaisuuksien välillä.
Esimerkiksi, kun valo siirretään liuoksen kautta, on olemassa kaksi intensiteettiä: tapahtuva voimakkuus (ennen liuoksen ylittämistä) ja lähetetyn intensiteetin (yleensä alhaisempi, mikä vastaa valon osuutta, jota liuos ei absorboi).
Molempien arvojen välinen suhde tunnetaan prosessoinnina, ja sen arvot ovat välillä 0 ja 1 tai ilmaistaan prosentteina.
Absorbanssi liittyy logaritmisen tavan prosessointiin, ja Beer-Lambertin laki ehdottaa lineaarista suhdetta liuoksen absorbanssin ja sen pitoisuuden, sen molaarisen sukupuuttoon ja liuoksen optisen kertoimeen; Tätä lakia kuvaava matemaattinen yhtälö on seuraava:
Voi palvella sinua: Haitallinen eläimistö: Leviämisen syyt, seuraukset, hallintaA (absorbanssi) = ε (molaarinen sukupuuttokerroin) C (konsentraatio) L (valon läpäisypituus)
Liuoksen pitoisuus lasketaan puhdistamalla mainitun yhtälöstä tuntematon ja suorittamalla asiaankuuluvat laskelmat (c = a/εl)
Mikä on spektrofotometri?
Se on laite, jota käytetään valon määrän määrittämiseen (aallonpituudesta riippuen), joka absorboi molekyylit liuoksessa tai toisin sanoen niiden ohittamisen valon määrä.
Spektrofotometrit toimivat säteilemällä valonsäde (näkyvä tai ultravioletti), joka kulkee prisman (tai nimellä tunnettu laite diffraktioverkon monokromaattori) se hajottaa sen eri aallonpituuksilla, jotka tekevät siitä, mikä antaa "valita" tietyn pituuden.
Tämä valo johdetaan erityisen putken läpi, joka sisältää analysoidun näytteen ja saavuttaa myöhemmin ilmaisimen, joka havaitsee mainitusta näytteestä (jota ei imeytynyt) välitetyn valon määrän, joka voidaan havaita myöhemmin "tulkin" ansiosta, että "tulkin" ansiosta " on graafinen rajapinta.
Väri: Coomassie -sininen Loistava sininen G 250
Tämän menetelmän tärkein reagenssi on epäilemättä väriaine, jota käytettiin näytteen proteiinien "merkitsemiseen". Bradford ehdotti työtä, koska tämä väriaine on olemassa kahdella tavalla: yksi punainen ja yksi sininen. Punaisesta muodosta tulee sininen muoto, kun väriaine sitoutuu proteiiniin, muodostaen kompleksin.
Sinisen proteiinin sinisellä kompleksilla on erittäin korkea molaarinen sukupuuttokerroin, mikä johtaa suurempaan herkkyyteen proteiinipitoisuuden kvantifioimiseksi analysoiduissa näytteissä.
Reagenssit
Vaikka tähän kvantifiointimenetelmään käytettyä ratkaisua markkinoidaan yleensä suljetuissa säiliöissä, jo valmistettuja -Bradford Reactive -, käytetyt pääreagenssit ovat:
- Coomassie -sininen Loistava sininen G50 (0.01% W/V)
- Fosforihappo (8.5 % W/V)
- Etanoli (4.7% w/v)
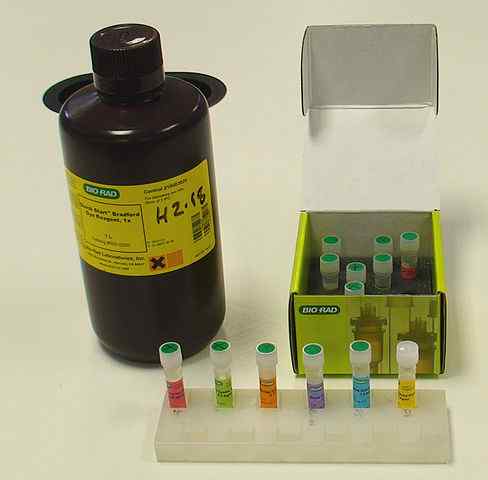 Proteiinin kvantifiointipakkaus Bradfordin menetelmällä (lähde: Vivo Rolfe, CC BY-SA 4.0, Wikimedia Commons) kautta)
Proteiinin kvantifiointipakkaus Bradfordin menetelmällä (lähde: Vivo Rolfe, CC BY-SA 4.0, Wikimedia Commons) kautta) Kuten missä tahansa menetelmässä ja proteiinin kvantifiointiprotokollissa spektrofotometrisillä menetelmillä, on välttämätöntä olla "standardi" tai "standardi" proteiini a kalibrointikäyrä Proteiinipitoisuuksiin liittyvien absorbanssiarvojen määrittämiseksi; Yleensä naudan seerumialbumiinia käytetään.
Voi palvella sinua: Chocolate AgarMenetelmä koostuu tiettyjen näytteiden määrien sekoittamisesta ongelma tietyillä Bradfordin reagenssin määrillä; Odota pari minuuttia väriaineproteiini-vuorovaikutusta ja värinmuutos on ilmeistä ja mitattu myöhemmin ja kirjata absorbanssiarvot seuraavien laskelmien suorittamiseksi.
Käyttää/sovelluksia
Bradfordin menetelmä on yksi maailman käytettyjen proteiinipitoisuuksien kvantifiointi- tai arviointimenetelmistä, lähinnä sen alhaisista kustannuksista johtuen nopeudella, jolla tulokset saadaan, proteiinin ja käytetyn väriaineen väliseen suureen stabiilisuuteen, sen toistettavuus ja vähimmäishäiriö, joka mittauksen aikana käytettyjen reagenssien komponenteilla on.
Menetelmää käytetään satoissa erilaisissa tieteellisissä sovelluksissa proteiinien määrittämiseksi eri yhteyksissä: fysiologiset, sytologiset, immunologiset, kliiniset, teolliset (etenkin elintarviketeollisuudessa) jne.
Kokeellisesti tämä menetelmä on erittäin hyödyllinen:
- Seuraa volyymien sisältämien proteiinien määrää, jotka saadaan asteittain kromatografisesta pylväästä (mm. Affiniteettipylväissä, ioninvaihto, absorptio, geelisuodatus) i) I.ja. Analysoi proteiinien puhdistusprotokollien fraktiot.
- Seuraa proteiinin määrää, joka on ladattu geeliin elektroforeesille.
- Arvioi yliekspressiojärjestelmässä saadun proteiinin määrä.
Viitteet
- Bonjoch, n. P., & Tamayo, P. R -. (2001). Proteiinipitoisuuden kvantifiointi Bradford -menetelmällä. Kasvien ekophysiologian käsikirjassa (PP. 283-295). Springer, Dordrecht.
- Bradford, M. M. (1976). Nopea ja herkkä menetelmä proteiinin mikrogrammimäärien kvantitoinnille käyttämällä pääproteiinin päivän sitoutumista. Analyyttinen biokemia, 72 (1-2), 248-254.
- Kielkopf, c. Lens., Bauer, W., & Urbatsch, I. Lens. (2020). Bradford -määritys proteiinipitoisuuden määrittämiseksi. Cold Spring Harbor -protokollat, 2020 (4), PDB-PROT102269.
- Sapan, c. V., Lundblad, r. Lens., & Hinta, n. C. (1999). Kolorimetriset proteiinimääritystekniikat. Bioteknologia ja sovellettu biokemia, 29 (2), 99-108.
- Walker, J. M. (Ed.-A. (1996). Proteiiniprotokollat käsikirja (Vol. 1996). Springer Science & Business Media.

