Kaliumnitriitti (kno2) rakenne, ominaisuudet ja käytöt

- 1939
- 444
- Edgar VonRueden
Hän Kaliuminitriitti Se on epäorgaaninen suola, jonka kemiallinen kaava on kuin2, joka liittyy kemiallisesti ja farmakologisesti kaliumnitraattiin3. Hänen fyysinen ulkonäkönsä koostuu kellertävistä valkoisista kiteistä, erittäin hygroskooppisista ja siksi herkuista; eli ne liukenevat nopeasti kosteisiin ympäristöihin.
Sen kaava osoittaa, että K -ionien osuus+ ja ei2- Se on 1: 1, ja se pysyy sähköstaattiset voimat tai ioniset linkit. Puhtaat luonnolliset lähteet eivät ole ilmeisesti löydetty kiteistään, vaikka niter -anionit löytyvät maaperästä, lannoitteista, kasveista ja eläimistä.
 Kalium -ntalikiteitä. Lähde: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Kalium -ntalikiteitä. Lähde: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Yläkuva osoittaa, kuinka Knon kiteet näyttävät2, Selkeillä keltaisilla sävyillä. Jos nämä kiteet jätetään kosketukseen ilman kanssa, ne imevät kosteuden tullakseen vesiliuokseksi; ratkaisu, joka on aiheuttanut kiistoja suhteessa suhteessa siihen, onko sen käyttö vai ei.
Toisaalta sen kiteitä, hyvin pienissä määrissä (200 ppm), käytetään lihan suolaamiseen ja niiden säilyttämiseen bakteerien vaikutuksia vastaan. Myös kno2 Parantaa lihan väriä kääntämällä niitä punertaviksi; Se on kuitenkin useita rajoituksia tämän suolan myrkyllisten vaikutusten välttämiseksi kehossa.
[TOC]
Kaliumnitriittimuoto
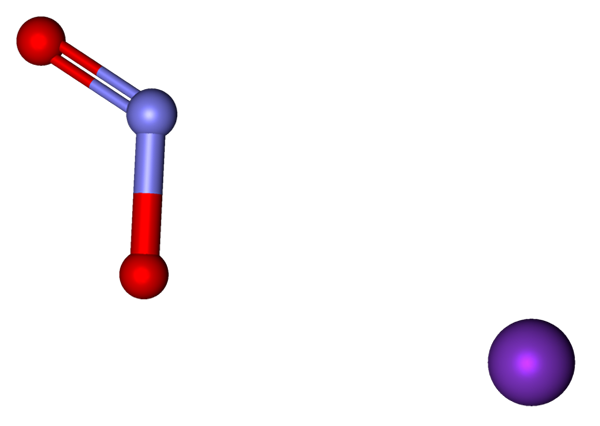 Ionit, jotka muodostavat kno2: n edustavat mallin palloja ja palkkeja. Lähde: Marinavladivok [CC0].
Ionit, jotka muodostavat kno2: n edustavat mallin palloja ja palkkeja. Lähde: Marinavladivok [CC0]. Kaliumnitriitissä olevat ionit on esitetty yllä. Kationi k+ vastaa violetti palloa, kun taas anioni ei2- Sitä edustavat sinertävän ja punaisen pallon.
Anionin ei2- Se on esitetty kaksoissidoksella ja yksinkertaisella [o = n-o]-; Mutta todellisuudessa molemmat linkit ovat samat kuin negatiivisen kuorman resonanssin seurauksena.
K -ionit+ ja ei2- Ne houkuttelevat toisiaan avaruudessa järjestämään rakenteellisen kuvion vähiten energialla; Tämä on, missä tasavertaisten kuormien väliset torjut ovat minimaalisia. Ja niin kno -kiteet uskovat2, jonka yksikkösolu on alttiina lämpötilan muutoksille, mitkä vaihesiirtymät.
Voi palvella sinua: Stanislao CannizzaroEsimerkiksi alhaisissa lämpötiloissa (alle 25 ° C) KnO -kiteet2 Hyväksy monokliininen järjestelmä (vaihe I). Kun lämpötila ylittää 25 ° C, tapahtuu rhombobinen monokliininen faasin siirtymä (vaihe II). Lopuksi, yli 40 ° C KnO -kiteet2 Vaihda kuutiometriä (vaihe III).
Myös kno2 voi osoittaa muita kiteisiä faaseja (vaiheet IV, V ja VI) korkeissa paineissa. Tämän kanssa K -ionit+ ja ei2- He lopulta liikkuvat ja tilasivat eri tavoin puhtaissa kiteissä.
Ominaisuudet
Molekyylimassa
85 1038 g/mol.
Tiheys
1 9150 g/ml.
Sulamispiste
440,02 ° C (mutta alkaa hajota 350 ° C: sta, säteilemällä myrkyllisiä höyryjä).
Kiehumispiste
537 ° C (räjähdys).
Vesiliukoisuus
312 g/ 100 g vettä 25 ° C: ssa.
Herkut
Sen liukoisuus veteen on sellainen, että se on hygroskooppinen; Niin paljon, sillä on herkkua, absorboi riittävästi kosteutta liukenemiseksi. Tämä affiniteetti veteen voi johtua K -ionien saavan energian vakauden suhteen+ Kniokiteille kosteuttaessa sekä alhainen kiteinen verkon entalpia2.
Kiteet voivat absorboida vettä liu'uttamatta hydraatiksi2· H2JOMPIKUMPI. Hydraatissa vesimolekyyli seuraa ioneja, jotka modifioivat kiteistä rakennetta.
Tämä hydraatti (tai useat niistä) voidaan muodostaa alle -9 ° C; Korkeammassa lämpötilassa vesi liukenee ja kosteuttaa ioneja, muodonmuutos lasia.
Liukoisuus muihin liuottimiin
Liukenevat hieman kuumissa alkoholissa ja liukenevat ammoniakkiin.
PHE
6-9. Sen vesipitoiset liuokset ovat siksi alkali, koska anioni ei2- Se voi hydrolyisoida.
Nimikkeistö
Kno2 Se voidaan nimetä myös muilla tavoilla. 'Kaliumnitriitti' vastaa tämän suolan nimeä varastossa nimikkeistön mukaan; 'Kaliumnitrito', systemaattisen nimikkeistön mukaan, jossa kaliumin ainoa valenssi, +1 on korostettu; ja kaliumin dioksonitraatti (III), systemaattisen nimikkeistön mukaan.
Se voi palvella sinua: Dibenzalacetona: Ominaisuudet, reaktiomekanismi, käyttö, riskitKaliumdioksonitraatti (III) korostaa typpiatomin valenssi +3. Jopa IUPAC: n suosittama nimi Knolle2, 'Kaliumnitriitti' on edelleen mukavin ja helpoin muistaa.
Saada
Suorin tapa syntetisoida sitä, mutta alhaisempi suorituskyky on kaliumnitraatin tai suolapetterin lämpöhajoamisen kautta vähintään 400 ° C: ssa:
2KNO3 => Kno2 + JOMPIKUMPI2
Kuitenkin osa knoa2 Lopuksi hajoaa lämmön mukaan muiden tuotteiden lisäksi.
Toinen menetelmä sen valmistelemiseksi tai syntetisoimiseksi korkeammalla suorituskyvyllä on vähentää kno3 Lyijyn, kuparin tai sinkin läsnä ollessa. Tämän reaktion yhtälö on seuraava:
Kno3 + Pb => kno2 + Pbo
Kalium ja lyijy nitraatti sekoitetaan stökiometrisesti rautapannuun, missä ne sulautuvat jatkuvaan levottomuuteen ja lämmitykseen puoli tuntia. Lyijyoksidi (II) on keltainen ja tuloksena oleva taikina on kuuma ja käsitelty kiehuvalla vedellä. Sitten kuumat seossuodattimet.
Kuuma suodatinkuplat hiilidioksidilla viiden minuutin ajan, mikä saostaa lyijykarbonaatin, PBCO3, liukenematon. Tällä tavoin lyijyjohto on valmis. Suodatukseen laimennettu typpihappo lisätään, kunnes pH on neutraali, sen annetaan jäähtyä ja lopulta vesi haihtuu siten, että Knon kiteet muodostuvat2.
Sovellukset
Additiivinen ja reagenssi
Kaliumnitriittiä käytetään lisäaineena punaisen lihan parantamiseksi, niiden maun ja enemmän aikavärin säilyttämisen aikana, kun taas bakteerien vaikutukset ja tiettyjä toksiineja, kuten botuliinics. Siksi sillä on antibakteerinen vaikutus.
Kno2 Se hapettuu, mikä reagoi lihan myoglobiinin kanssa ja siten päätyy modifioimaan sen luonnollista punaista väriä. Sitten, kun liha on kypsennetty, se saa ominaisen voimakkaan vaaleanpunaisen värin.
Voi palvella sinua: 20 esimerkkiä kemiallisesta sublimaatiosta ja ominaisuuksistaKuitenkin olosuhteissa määrittelemättä knoa2 Reagoi lihaproteiinien kanssa nitrosamiinin aiheuttamiseksi, josta voi tulla syöpää aiheuttavia.
Toisaalta kno2 (vaikka mieluiten nano2) Se on analyyttinen reagenssi, jota voidaan käyttää atsoisten väriaineiden synteesissä (typpihapon reaktio aromaattisten amiinien kanssa) ja aminohappoanalyysissä.
Vasta -aine
Vaikka sillä on kielteisiä vaikutuksiaan, Kno2 Se toimii vasta -aineena myrkyllisillä potilailla, joilla on syanidit ja rikkivety. Sen mekanismi on hapettua uskon keskuksia2+ uskoa3+ Niistä ryhmistä, jotka meillä on hemoglobiineista, tuottaen methemoglobiinia, joka sitten reagoi CN -anionien kanssa- ja HS-.
Lääkärit
Vatsan mahalaukun mehussa anioni ei2- Se on vähennetty, jolla tiedetään olevan verisuonia laajentavaa vaikutusta, mikä lisää verenvirtausta. Muilla kehon alueilla, joilla pH ei ole tarpeeksi happoa, jotkut entsyymit, kuten Oxidorted Xanthina, ovat vastuussa vähentämisestä2-.
Kno on käytetty2 Virallisten ja sairauksien, kuten rintakehän ja epilepsian, hoitamiseksi (erittäin negatiivisilla sivuvaikutuksilla).
Viitteet
- Wikipedia. (2019). Kaliuminitriitti. Haettu: vuonna.Wikipedia.org
- Prebchem. (2016). Valmistus kaliumnitriitti. Palautettu: prepchem.com
- Mark Gilchrist, Angela C. Ranta, Nigel Benjamin. (2011). Epäorgaaninen nitraatti ja nitriitti ja verenpaineen hallinta, sydän- ja verisuonitutkimus, osa 89, numero 3, 15. helmikuuta 2011, sivut 492-498, doi.org/10.1093/CVR/CVQ309
- Pubchem. (2019). Kaliuminitriitti. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Kemiallinen formulaatio. (2018). Kaliuminitriitti. Palautettu: quimica -formulaatio.com
- Kansallinen käännöstieteiden edistämiskeskus. (2011). Kaliuminitriitti. Toipunut: Huumeet.Ncats.Io
- Richard J. Eley, Paul B. Addis ja Joseph J. Wartheen. (1992). Nitriitti lihassa. Minnesotan yliopisto.
- N. R -. Rao, b. Prakash ja m. Natarajan. (1975). Kristallirakenteen muunnokset epäorgaanisissa nitriiteissä, nitraatissa ja karbonaatissa. Kemian laitos, Intian teknillinen instituutti, Kanpur, Intia.
- « Poliittiset puheen ominaisuudet, tyypit, kysymykset ja esimerkit
- Jätteiden pilaantumisen syyt, seuraukset ja esimerkit »

