Natriumnitriitti (nano2) rakenne, ominaisuudet, käyttötarkoitukset, riskit

- 688
- 13
- Juan Breitenberg V
Hän natriumnitriitti Se on kiteinen epäorgaaninen kiinteä aine, joka on muodostettu natrium -ionilla+ ja nitriitti -ioni ei2-. Sen kemiallinen kaava on nano2. Se on valkoinen kiteinen kiinteä aine, jolla on taipumus absorboida vettä ympäristöstä, ts.
Ilman läsnä ollessa hapettaa hitaasti nitraattitraatin3. Siinä on hapettumisominaisuuksia (hapettuneet muut yhdisteet) ja myös pelkistimen (muut yhdisteet hapettuu).
 Nano -natriumnitriitti2. Aleksander Sobolewski Wikimedia Commonsin kautta [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Nano -natriumnitriitti2. Aleksander Sobolewski Wikimedia Commonsin kautta [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Sitä on läsnä ihmisen organismissa luonnollisesti ja sitä käytetään kovetettujen lihojen ja savustetun kalan säilöntäaineena, koska se välttää haitallisten mikro -organismien kasvua.
Sillä on tärkeä käyttö syanidimyrkytyksen kiireellisessä hoidossa, koska mainitun yhdisteen myrkyllinen ja tappava vaikutus vähenee. Sitä on kuitenkin annettava erittäin varovaisesti eikä toimi kaikissa tapauksissa.
On havaittu, että se voisi estää silmien infektioita, jotka johtuvat piilolinssien saastumisesta mikro -organismeilla. Jotkut tutkimukset osoittavat, että heidän ruoan kulutus voi aiheuttaa syöpää, mutta arvioidaan, että tämä voidaan välttää syömällä C -vitamiinia sellaisilla elintarvikkeilla.
[TOC]
Rakenne
Natriumnitriitti muodostuu natriumkationista+ Ja nitriittien anionin2-.
Nitriitti -anionissa2- Typen valenssi on +3 ja happi -2, tästä syystä anionilla on yksi globaali negatiivinen kuorma.
Nitrite -anionin ei2- Sillä on kulmarakenne, toisin sanoen typpisidokset (n) happiatomien kanssa (O) muodostavat kulman.
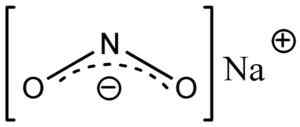 Nano -natriumnitriittien rakenne2, missä näet nitriitti -anionin kulmamuodon2-. Eschenmoser [julkinen alue]. Lähde: Wikimedia Commons.
Nano -natriumnitriittien rakenne2, missä näet nitriitti -anionin kulmamuodon2-. Eschenmoser [julkinen alue]. Lähde: Wikimedia Commons. Nimikkeistö
- Natriumnitriitti
- Natriumnitriitti
- Typpihappo -natriumsuola.
Ominaisuudet
Fyysinen tila
Kellertävä valkoinen kiteinen kiinteä. Ortorromiset kiteet.
Molekyylipaino
68 995 g/mol
Sulamispiste
271 ºC
Kiehumispiste
Älä kiehu. Se hajoaa yli 320 ºC
Se voi palvella sinua: Magnesium hydridi: rakenne, ominaisuudet ja käytötTiheys
2,17 g/cm3 20 ºC
Liukoisuus
Vesiliukoinen: 84,8 g/100 g vettä 25 ° C: ssa. Liukenee hiukan etanoliin. Kohtalaisen liukoinen metanoliin. Tuskin liukoinen dietyl -eetterissä.
PHE
Sen vesipitoiset liuokset ovat emäksistä, pH noin 9. Tämä johtuu siitä, että typpihappo on heikko happo, jolla ei ole taipumusta dissosioitua, joten ioni ei2- Yritä ottaa protoni H+ Vettä HNO: n muodostamiseksi2, mikä johtaa OH -ionin muodostumiseen- Ne tuottavat emäksisyyttä.
EI2- + H2O → hno2 + vai niin-
Muut ominaisuudet
Nano -natriumnitriitti2 Ilman läsnä ollessa hapettaa hitaasti nitraattitraatin3. Se on hygroskooppinen kiinteä aine, koska se imee vettä ympäristöstä.
Siinä on hapettavia ominaisuuksia (se voi hapettaa muita yhdisteitä) ja myös pelkistimet (muut yhdisteet voivat hapettaa sen).
Jos joudut kosketuksiin materiaalien, kuten puun, paperin tai tekstiilien kanssa, voit saada ne tulemaan palamiseen vaarallisesti.
Happojen kanssa sen hajoaminen tapahtuu, mikä tuottaa typpioksidien myrkyllisiä kaasuja (eix-A.
Saada
Se voidaan saada kuumentamalla nano -natriumnitraattia3 Lyijyn PB: n kanssa:
Vanhempi veli3 + PB → Nano2 + Pbo
Läsnäolo organismissa
Nitriitti -anionia on luonnollisesti läsnä veressä ja kudoksissa, koska se muodostuu ei -hapettumisen seurauksena.
Sovellukset
Elintarviketeollisuudessa
Sitä käytetään Adobar -lihaa, koska se toimii väri- ja maun pidättämisaineena ja säilöntäaineena, koska se hallitsee mikro -organismien kasvua, välttäen erityisesti kehityksen kehitystä Clostridium botuliini Aiheuttaen botulismitaudin.
Natriumnitriitti lihassa reagoi punasolujen tai tämän ruoan punasolujen hemoglobiinin kanssa. Sitä käytetään myös kovetettuun savustettuun kalaan.
 Savustettu kala. Kirjoittaja: Reinhard Thrainer. Lähde: Pixabay.
Savustettu kala. Kirjoittaja: Reinhard Thrainer. Lähde: Pixabay. Syanidimyrkytyksen hätäkäsittelynä
Natriumnitriittiä käytetään akuutin syanidimyrkytyksen käsittelyyn. Se on vastalääke tälle vakavalle ongelmalle.
Voi palvella sinua: asetonitriili (C2H3N)Sen vaikutus johtuu tosiasiasta, että se suosii veressä methemoglobiinin muodostumista (tyyppistä hemoglobiinia), joka tarttuu syanidi -ioneihin ja ei vapauta niitä, ja siten estää niitä vapautumasta soluissa, mikä tekee niistä vähemmän myrkyllisiä.
Syanidimyrkytyksen tapauksessa natriumnitriittiä levitetään laskimonsisäisesti, mikä vie noin 12 minuuttia methemoglobiinin tuottamiseksi. Tästä viivästyksestä huolimatta se tarjoaa myös verisuonia laajentavan vaikutuksensa.
 Laskimonsisäinen hoito. Michaelberry englanniksi Wikipedia [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons.
Laskimonsisäinen hoito. Michaelberry englanniksi Wikipedia [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons. Verisuonten laajentumiseen
Sen tarkoituksena on hoitaa keuhkovaltimoiden verenpainetauti, koska se toimii viivästyttämällä verisuonia siten alentamalla verenpainetta. On arvioitu, että tämä vaikutus johtuu siitä, että se muuttuu typpioksidiksi, joka ei sisällä pehmeitä lihaksia rentouttavia.
Niiden tehokkuuden syyt ovat kuitenkin edelleen tutkittuja.
Joitain loisia vastaan
Tietyt tutkijat havaitsivat, että natriumnitriitti estää suoliston loisen kasvua ja kertolaskua Blastocystis hominis Vaikka tämä olisi vastustuskykyinen muille lääkkeille.
Todettiin, että nano2 Se aiheuttaa tämän loisen kuoleman apoptoosilla, joka on eräänlainen loiskennon itsemurha. Natriumnitriitti saa suoliston solut tuottamaan EI, mikä näyttää olevan tärkeä tässä prosessissa.
Elinvaurioiden välttämiseksi
Joidenkin tutkimusten mukaan nitriitti on voimakas sydänvaurioiden ja maksan estäjä iskemiaprosesseissa (vähentynyt verenkastelu kehon osassa). Uskotaan, että tämä johtuu siitä, että se on ei.
Pääteltiin, että sitä voidaan käyttää estämään elinten vauriot sen jälkeen, kun sydänkohtaus on keskeyttänyt verenvirtauksen, korkean riskin vatsan kirurginen interventio tai joidenkin elinten siirto.
Välttää kosketuslinssien käytön tartuntoja välttää
On todettu, että nano2 estää patogeenisten mikro -organismien filmien muodostumisen Staphylococcus aureus ja Pseudomonas aeruginosa Tietoja piilolinsseistä.
Voi palvella sinua: pelkistys (kemia) Piilolinssit voivat olla saastuneita bakteereilla tai sienillä. Kosketuslinssivalokuvaus 7. tammikuuta 2006. Lähde: Valokuva BPW: lle. Lähde: Wikimedia Commons.
Piilolinssit voivat olla saastuneita bakteereilla tai sienillä. Kosketuslinssivalokuvaus 7. tammikuuta 2006. Lähde: Valokuva BPW: lle. Lähde: Wikimedia Commons. Useissa käyttötarkoituksissa
Natriumnitriittiä käytetään värityksen, lääkkeiden ja erilaisten orgaanisten yhdisteiden valmistukseen.
Se toimii myös korroosion estäjänä useissa rasvoissa.
Riskejä tai haittoja
Yksi natriumnitriitin käytön ongelmista syanidimyrkytysten suhteen on, että se aiheuttaa vakavia sydän- ja verisuonihäiriöitä lapsilla.
Palon uhreille ei suositella, että sekä syanidin että hiilimonoksidin (CO) samanaikainen altistuminen (CO). CO vähentää veren kykyä kuljettaa happea, joten nanon antaminen2 pahentaisi pienen hapen tilaa potilaan veressä.
Hengitetty natriumnitriitti on ärsyttävä ja myrkyllinen, se voi vahingoittaa sydän- ja verisuonijärjestelmää ja keskushermostoa. Lisäksi hän on haitallinen ympäristölle.
Ruokalla nautittu natriumnitriitti voi olla haitallista. Nitriitti saapuessaan vatsaan reagoi tiettyjen yhdisteiden kanssa, jotka muodostavat nitrosamiineja, jotka voivat tuottaa syöpää.
Nämä reaktiot voidaan välttää C -vitamiinin läsnä ollessa.
Tietyn kuultujen lähteiden mukaan nitriittien kuluttamisen riski parannetulla lihalla tai kaloilla on minimaalinen, koska nitriitti on luonnollisesti läsnä sylkessä.
Lähteet osoittavat, että tämä riski on myös minimaalinen verrattuna ruoan kuluttamisen suuriin hyötyihin haitallisista mikro -organismeista.
Viitteet
- Bhattacharya, r. ja kasvisto, s.J -.S. (2015). Syanidimyrkyllisyys ja sen hoito. Kemiallisten sodankäynnin agenttien toksikologian käsikirjassa (toinen painos). ScienEdirect.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Natriumnitriitti. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus.
- Kim, D.J -. et al. (2017). Typpioksidin antibiofilmien tehokkuus pehmeässä kosketuslinssissä. BMC Ophthalmol 17, 206 (2017). Haettu BMCophthalmolista.biolääketieteellinen.com.
- Ramis-Ramos, G. (2003). Antioksidantit. Synteettiset antioksidantit. Elintarviketieteiden ja ravitsemuksen tietosanakirjassa (toinen painos). ScienEdirect.
- Barozzi Seabra, a. ja Durán, n. (2017). Typpioksidin luovuttajat laiminlyötyjen sairauksien hoitamiseksi. Typpioksidin luovuttajissa. ScienEdirect.com.
- Duranski, m.R -. et al. (2005). Nitriitin sytoprotektiiviset vaikutukset sydämen ja maksan in vivo-iskemian reperfuusion aikana. J Clin Invest 2005; 115 (5): 1232-1240. NCBI toipunut.Nlm.NIH.Hallitus.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- « Kulttuurimedia, toiminto, tyypit, valmistelu
- Hyvää 50 syntymäpäivää kauniita lauseita omistautua »

