Nitrobentseeni (C6H5NO2) rakenne, ominaisuudet, käyttö, riskit

- 3229
- 443
- Mr. Clifford Kshlerin
Hän nitrobentseeni Se on aromaattinen orgaaninen yhdiste, jonka on muodostanut bentseenirengas C6H5- Ja nitro -ei -ryhmä2. Sen kemiallinen kaava on c6H5EI2. Se on värikäs tai vaaleankeltainen öljyinen neste, jossa on katkera mantelit tai kengät.
Nitobentseeni on erittäin hyödyllinen yhdiste kemianteollisuudessa, koska se mahdollistaa sarjan kemiallisia aineita, jotka ovat monimuotoisia käyttötarkoituksia. Tämä johtuu siitä, että siihen voidaan kohdistaa erityyppiset reaktiot.
 Nitrobenenene, c6H5-EI2. Kirjoittaja: Marilú Stea.
Nitrobenenene, c6H5-EI2. Kirjoittaja: Marilú Stea. Tärkeiden kemiallisten reaktioiden joukossa ovat nitraatio (jonka avulla voit lisätä lisää ryhmiä -ei2 molekyylille) ja pelkistys (hapettumisen vastakohta nitro -ryhmän kahdella happiatomilla -ei eliminoitu2 ja korvataan hydrogeneilla).
Nitrobeneenin avulla voit valmistaa esimerkiksi aniliinin ja para-asetaminofenolin. Jälkimmäinen on hyvin tunnettu asetaminofeeni, joka on antityreettinen (kuumelääke) ja pehmeä kipulääke (vähäinen kipulääke).
Nitobentseeniä on manipuloitava varoen, koska se on ärsyttävä ja myrkyllinen, se voi aiheuttaa anemian tyyppisen, useiden oireiden joukossa, ja uskotaan, että se voi aiheuttaa syöpää. Se on myös haitallista ympäristölle.
[TOC]
Rakenne
Nitrobentseeni C6H5-EI2 Se on litteä molekyyli, jonka on muodostanut bentseenirengas C6H5- johon nitroryhmä on linkitetty -ei2. Sen molekyyli on tasainen, koska nitro -NO -ryhmän välillä on elektroninen vuorovaikutus2 ja bentseenirengas.
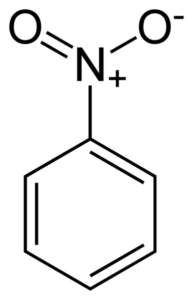 Nitrobentseenimolekyylin tasainen rakenne. Double Bondyan -rengaslinkkien elektronit yleensä ovat vuorovaikutuksessa nitro -ei -ryhmän kanssa2. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
Nitrobentseenimolekyylin tasainen rakenne. Double Bondyan -rengaslinkkien elektronit yleensä ovat vuorovaikutuksessa nitro -ei -ryhmän kanssa2. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Nitro -no -ryhmä2 on taipumus houkutella bentseenirenkaan C elektroneja6H5-.
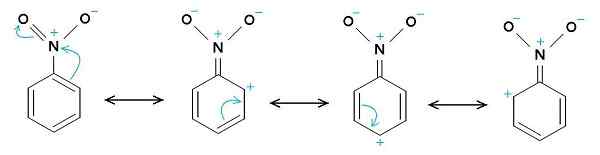 Nitrobentseeniresonanssirakenteet. Bentseenirenkaassa on yleensä positiivinen kuorma, kun taas nitro -NO2 -ryhmällä on yleensä negatiivinen kuorma. Alkuperäinen lähettäjä oli Samuele Madini Italian Wikipediassa. [Julkinen verkkotunnus]. Lähde: Wikimedia Commons.
Nitrobentseeniresonanssirakenteet. Bentseenirenkaassa on yleensä positiivinen kuorma, kun taas nitro -NO2 -ryhmällä on yleensä negatiivinen kuorma. Alkuperäinen lähettäjä oli Samuele Madini Italian Wikipediassa. [Julkinen verkkotunnus]. Lähde: Wikimedia Commons. Siksi molekyylillä on hiukan negatiivisempi puoli (missä -ei -happi on2) ja hieman positiivisempi puoli (bentseenirengas).
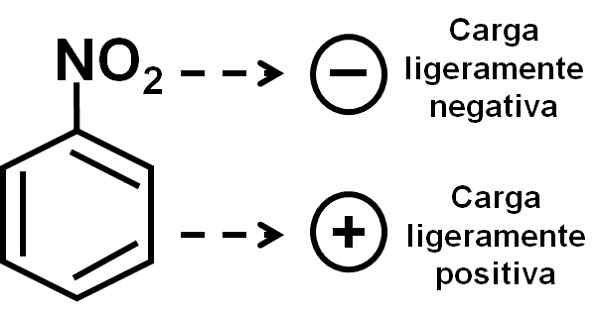 Nitroryhmän happea on hiukan negatiivinen kuorma verrattuna bentseenirenkaaseen. Kirjoittaja: Marilú Stea.
Nitroryhmän happea on hiukan negatiivinen kuorma verrattuna bentseenirenkaaseen. Kirjoittaja: Marilú Stea. Nimikkeistö
- Nitrobentseeni.
- Nitrobenze.
- Nitrobentsoli.
- Öljy tai Mirbanon tai Mirbanan olemus (käytöstä poistettu termi).
Ominaisuudet
Fyysinen tila
Värikäs öljyinen neste vaaleankeltaiseksi.
Molekyylipaino
123.11 g/mol.
Sulamispiste
5,7 ºC.
Kiehumispiste
211 ºC.
Se voi palvella sinua: kobolttikloridi (cocl2 (: rakenne, nimikkeistö, ominaisuudetLeimahduspiste
88 ºC (suljettu kuppimenetelmä).
Itsensuuntainen lämpötila
480 ° C.
Tiheys
1 2037 g/cm3 20 ºC.
Liukoisuus
Pikku vesiliukoinen: 0,19 g/100 g vettä 20 ° C: ssa. Täysin sekoittuu alkoholin, bentseenin ja dietyl -eetterin kanssa.
Kemialliset ominaisuudet
Nitrobeneneini on stabiili noin 450 ° C: n lämpötilaan, jossa se alkaa hajottaa muodostumista (hapen puuttuessa) ei, ei2, bentseeni, bifenyyli, aniliini, dibentsofurano ja naftaleeni.
Nitrobenenseenin tärkeiden reaktioiden joukossa ovat pelkistys, nitraatio, halogenointi ja sulfonaatio.
Nitrobentseeninitraatio tuottaa alun perin meta-nitrobentseeniä ja reaktiona pitkällä ajalla saadaan 1,3,5-nitobentseeni.
Bromin tai kloorin reaktio nitrobentseenin kanssa sopivan katalyytin läsnä ollessa saadaan 3-bromi-nitrobentseeni (metabromonitrobenenseeni) tai 3-plor-nitrobentseeni (meta-klooritrobentseeni).
Esimerkki pelkistämisestä on, että kun käsitellään tinaa (SN) suolahapossa (HCL), meta-halogenonitobentseenit saadaan meta-halogenoanyyyliinillä.
Nitrobentseenin sulfonaatio suoritetaan tupakointi rikkihapolla 70-80 ° C: ssa ja tuote on meta-nitrobenzeulfoninen meta-nitrobenze. Tätä voidaan vähentää rauta- ja HCL: llä metanyylihapon antamiseksi.
Himmentimen muodostuminen
Bentseeniliuoksessa C6H6 Nitrobeneenimolekyylit liittyvät toisiinsa muodostuvien halkaisijan tai molekyylien pareihin. Näissä pareissa yksi molekyyleistä on käänteisessä asennossa toiseen nähden.
Nitrobentseenin halkaisijoiden muodostuminen molekyylien kanssa yksi käännetyssä asennossa toiseen nähden johtuu mahdollisesti siitä, että jokaisella niistä on hiukan positiivisempi ja vastakkainen puoli, jolla on hieman negatiivinen kuormitus.
Dimeerissä sivu, jolla on hieman enemmän positiivisempaa kuormitusta yhden molekyyleistä.
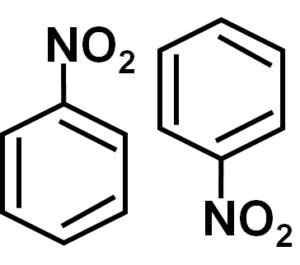 Nitrobenenseen luku, toisin sanoen kaksi molekyyliä, jotka yleensä ovat yhdessä joissain liuottimissa. Kirjoittaja: Marilú Stea.
Nitrobenenseen luku, toisin sanoen kaksi molekyyliä, jotka yleensä ovat yhdessä joissain liuottimissa. Kirjoittaja: Marilú Stea. Muut ominaisuudet
Se esittelee hajun, joka on samanlainen kuin mantelit tai kiillottaa kenkiä. Alentamalla sen jähmettyä lämpötilaa vihertävän keltaisten kiteiden muodossa.
Saada
Käsittelet bentseeniä C6H6 Typpihappo -HNO -seoksella3 ja rikkihappo H2Sw4. Prosessia kutsutaan nitraatioksi ja siihen sisältyy nitroniumionien muodostuminen2+ Rikkihapon H läsnäolon ansiosta2Sw4.
- Nitronio -ioni ei2+-
Hno3 + 2 h2Sw4 H3JOMPIKUMPI+ + 2 HSO4- + EI2+ (Nitronio -ioni)
- Nitronio -ioni hyökkää bentseeniin:
Voi palvella sinua: systemaattinen virhe: Kuinka laskea se, kemiassa, fysiikassa, esimerkkejäC6H6 + EI2+ → C6H6EI2+
- Nitrobenenene on muodostettu:
C6H6EI2+ + HSO4- → C6H5EI2 + H2Sw4
Yhteenvetona:
C6H6 + Hno3 → C6H5EI2 + H2JOMPIKUMPI
Bentseeninitrareaktio on hyvin eksoterminen, toisin sanoen hyvin lämpöä syntyy, joten se on erittäin vaarallinen.
Sovellukset
Aniliinin ja asetaminofeenin saamiseksi
Nitrobeneenia käytetään pääasiassa aniliinin C syntetisointiin6H5Nh2, joka on laajalti käytetty yhdiste torjunta -aineiden, ikenien, väriaineiden, räjähteiden ja lääkkeiden valmistukseen.
Aniliinin saaminen tapahtuu vähentämällä nitrobentseeniä happamassa väliaineessa raudan tai tinan läsnä ollessa, joka suoritetaan seuraavien vaiheiden mukaisesti:
Nitrobentseeni → nitrosobentseeni → fenyylihydroksyyliamiini → aniliini
C6H5EI2 → C6H5Ei → c6H5Nhoh → c6H5Nh2
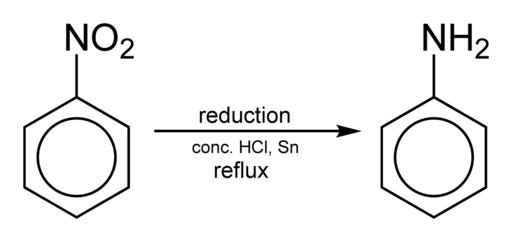 Nitrobenenseenin vähentäminen aniliinin saamiseksi. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
Nitrobenenseenin vähentäminen aniliinin saamiseksi. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Olosuhteista riippuen prosessi voidaan pysäyttää yhdessä välivaiheessa esimerkiksi fenyylihydroksyyliamiinissa. Alkaen fenyylihydroksyyliamiinista voimakkaasti happamassa ympäristössä, para-aminofenoli voidaan valmistaa:
Fenyylhdroksyyliamiini → p-Aminofenoli
C6H5NHOH → HOC6H4Nh2
Jälkimmäistä käsitellään etikkahappoanhydridillä paretamolin (asetaminofeenin) saamiseksi lempeän antityreettisen ja pehmeän kipulääkkeen, ts.
 Joskus on mahdollista lääkittää asetaminofeenilla kuumeen lapsille. Asetaminofeeni on nitrobentseenijohdannainen. Kirjoittaja: Augusto Ordonez. Lähde: Pixabay.
Joskus on mahdollista lääkittää asetaminofeenilla kuumeen lapsille. Asetaminofeeni on nitrobentseenijohdannainen. Kirjoittaja: Augusto Ordonez. Lähde: Pixabay.  Asetaminofeenipillerit, nitrobentseenijohdannainen. Parasetamol_asetaminofen_500_mg_pils.JPG: Michelle -heimo Ottawasta, Canadaderivative Work: Anrie [CC by (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons.
Asetaminofeenipillerit, nitrobentseenijohdannainen. Parasetamol_asetaminofen_500_mg_pils.JPG: Michelle -heimo Ottawasta, Canadaderivative Work: Anrie [CC by (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons. Toinen tapa saada aniliini on vähentämällä nitrobentseeniä hiilimonoksidilla (CO) vesipitoisessa väliaineessa paladiumin (PD) hyvin pienten hiukkasten (nanohiukkasten) läsnä ollessa katalyyttinä.
C6H5-EI2 + 3 Co + H2O → c6H5-Nh2 + 3 co2
Muiden kemiallisten yhdisteiden saamiseksi
Nitobentseeni on lähtökohta, jolla saadaan monenlaisia käytettyjä yhdisteitä, kuten väriaineita, torjunta -aineita, lääkkeitä ja kosmetiikkaa.
 Jotkut väriaineet saadaan nitrobentseenin ansiosta. Kirjoittaja: Edith Lüthi. Lähde: Pixabay.
Jotkut väriaineet saadaan nitrobentseenin ansiosta. Kirjoittaja: Edith Lüthi. Lähde: Pixabay. Esimerkiksi se mahdollistaa 1,3-dinitrobenenseenin saamisen, että klooraamalla (lisäys kloorin) ja vähentäminen (happiatomien eliminointi) tuottaa 3-klooranyliniä. Tätä käytetään torjunta -aineiden, väriaineiden ja lääkkeiden välittäjänä.
Nitobentseeniä käytettiin benchidiinin valmistukseen, joka on väriaine. Lisäksi nitrobentseeni palvelee kinoliinin, atsobentseenin, metanyylihapon, dyitobentseenin, isokianaatin tai pyroksiliinin valmistelua monien muiden yhdisteiden joukossa.
Useissa sovelluksissa
Nitobentseeniä käytetään tai käytetään seuraavasti:
Voi palvella sinua: tyydyttymättömät hiilivedyt- Uuttamisliuotin koneissa käytettyjen voiteluöljyjen puhdistamiseksi
- Liuotin selluloosan eettereille
- Seoksen ainesosa kiillotettuihin metalleihin
- Saippuissa
- Puolan kengän seoksissa
- Ruiskumaalin konservator
- Lattian kiillotusseoskomponentti
- Mantelin olemuskorvike
- Hajusteteollisuudessa
- Synteettisen kumin tuotannossa
- Liuotin erilaisissa prosesseissa
 Nitobentseeni on osa joitain seoksia kiillotettuihin kenkiin. D-Kuru [CC BY-SA 3.0 at (https: // creativecommons.Org/lisenssit/by-SA/3.0/at/teko.sisään)]. Lähde: Wikimedia Commons.
Nitobentseeni on osa joitain seoksia kiillotettuihin kenkiin. D-Kuru [CC BY-SA 3.0 at (https: // creativecommons.Org/lisenssit/by-SA/3.0/at/teko.sisään)]. Lähde: Wikimedia Commons. Riskejä
Nitobentseeni on myrkyllistä hengittämällä, nauttimisella ja imeytymisellä ihon läpi.
Ärsyttää ihoa, silmiä ja hengitysteitä. Se voi aiheuttaa tyyppisen anemian, jota kutsutaan methemoglobinemiaksi, joka koostuu punasolujen kyvyn vähentämisestä kudoksissa happea ja tuottaa väsymystä.
Lisäksi nitrobeneneini aiheuttaa hengenahdistusta, huimausta, järkyttynyttä visiota, hengityksen puutetta, romahtamista ja kuolemaa. Se vahingoittaa myös maksa, pernaa, munuaisia ja keskushermostoa.
On arvioitu, että se voi olla mutageeni ja mahdollisesti aiheuttaa ihmisen syöpää, koska se on aiheuttanut sen eläimissä.
Lisäksi nitrobeneenia ei pidä hylätä ympäristössä. Sen myrkyllisyys eläimille, kasveille ja mikro -organismeille tekee siitä erittäin haitallisen ekosysteemeille.
Myrkyllisyys mikro -organismeihin vähentää sen biohajottavuutta.
Hoidot ympäristön poistamiseksi
Ympäristön pilaantuminen nitrobeneenin kanssa voi tapahtua sitä käyttävien eri toimialojen, kuten väritysteollisuuden tai räjähteiden, jätteiden kautta.
Nitobentseeni on erittäin myrkyllinen ja vaikea hajottaa luonnollisissa olosuhteissa, tästä syystä se voi aiheuttaa vakavaa juomaketta saastumista ja kylvöä kastelujärjestelmiä.
Mikro -organismien korkean stabiilisuuden ja myrkyllisyyden vuoksi se valitaan usein malliksi jätevedenkäsittelytutkimuksissa.
Saastuneen veden nitrobentseenin poistamiseksi tutkitaan erilaisia tapoja. Yksi niistä on fotokatalyyttisen hajoamisen kautta, ts. Auringonvalon käyttäminen hajoamureaktion kiihdyttimenä titaanin titaanidioksidin läsnä ollessa2.
 Auringonvalon reaktorilla on mahdollista eliminoida veden pilaantuminen nitrobeneenin kanssa. Mihai-Cosmin Pascariu [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Auringonvalon reaktorilla on mahdollista eliminoida veden pilaantuminen nitrobeneenin kanssa. Mihai-Cosmin Pascariu [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Mikroelektrolyysimenetelmät on myös testattu onnistuneesti rautakatalyyttillä (Faith) ja kuparilla (CU) keramiikassa. Mikroelektrolyysi sallii nitrobentseenin hajoamisen sähkövirran läpi.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Nitrobentseeni. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Morrison, r.T. ja Boyd, R.N. (2002). Orgaaninen kemia. 6. painos. Prentice-sali.
- Moldoveanu, S.C. (2019). Muiden typpilaskujen yhdisteiden pyrolyysi. Orgaanisten molekyylien pyrolyysissä (toinen painos). ScienEdirect.com.
- Smith, P.W -.G. et al. (1969). Aromaattiset nitration-nitroyhdisteet. Elektrofiiliset substituutiot. Aromaattisessa kemiassa. ScienEdirect.com.
- Windholz, m. et al. (Toimittajat) (1983). Merck -indeksi. Kemikaalien, lääkkeiden ja biologisten enyclopedia. Kymmenes painos. Merck & Co., Inc.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Volume A22. Vch verlagsgellschaft mbh.
- Whang, t.-J -. et al. (2012). Nitrobentseenin UV-irtautunut fotokatalyyttinen hajoaminen Titanian sitoutumisella kvartsiputkessa. International Journal of PhotoEnergy, osa 2012, artikkelit ID 681941. Hyndawi toipui.com.
- Shikata, t. et al. (2014). Nitrobentseeni anti-sukulainen dimeerin muodostuminen ei-polaarisissa liuottimissa. AIP etenee 4, 067130 (2014). Toipunut Doajista.org.
- Krogul-Obczak, a. et al. (2019). Nitrobentseenin vähentäminen aniliiniksi CO/H: llä2Tai palladium -nanohiukkasten todistaja. Catalysts 2019, 9, 404. MDPI toipui.com.
- Yang, b. et al. (2019). Fe/Cu-katalyyttisen-keraamisen täyteaineen pilottisuuntainen tuotanto, ominaisuudet ja soveltaminen nitrobentseeniyhdisteille jätevesikäsittely. Catalysts 2019, 9, 11. MDPI toipui.com.
- « Mekaaninen etukaava, yhtälöt, laskelmat ja esimerkit
- 110 Iankaikkisia rakkauslauseita poikaystäville ja aviomiehille »

