Spektrimerkki

- 3034
- 477
- Gabriel Fahey
 Taulukko, joka osoittaa tasot ja kiertoradat
Taulukko, joka osoittaa tasot ja kiertoradat Mikä on spektrimerkinnät?
Se Spektrimerkki Se on elektronien järjestely energiatasoilla atomin ytimen ympärillä. Bohrin vanhan atomimallin mukaan elektronit miehittävät useita tasoja ytimen ympärillä olevalla kiertoradalla, ensimmäisestä ytimestä K -kerroksesta, K -seitsemänteen kerrokseen Q, joka on kauimpana ytimestä.
Hienostuneemman kvanttimekaanisen mallin kannalta K-Q-kerrokset jaetaan orbitaalien joukkoon, joista jokaista voi miehittää vain pari elektronia.
Yleensä elektronista konfiguraatiota käytetään kuvaamaan atomin kiertoratoja sen perustilassa, mutta sitä voidaan käyttää myös kationissa tai anionissa ionisoituneiden atomien edustamiseen, kompensoimalla elektronien menetys tai voitot vastaavissa kiertoradoillaan.
Monet elementtien fysikaaliset ja kemialliset ominaisuudet voivat korreloida niiden ainutlaatuisten elektronisten kokoonpanojen kanssa. Valencia -elektronit, uloimmassa kerroksen elektronit, ovat määritelty tekijä elementin ainutlaatuiselle kemialle.
Kun atomin uloimman kerroksen elektronit saavat jonkinlaista energiaa, ne siirtyvät suurempiin energiakerroksiin. Siten K -kerroksen elektroni siirretään kerrokseen L on suurimman energian tilassa.
Kun elektroni palaa perustilaansa, se vapauttaa sen absorboiman energian lähettämällä sähkömagneettista spektriä (valo). Koska jokaisella atomilla on erityinen elektroninen kokoonpano, sillä on myös tietty spektri, jota kutsutaan absorptio- (tai päästö) -spektriksi.
Tästä syystä termiä spektrimerkintöä käytetään viittaamaan sähköiseen kokoonpanoon.
Kuinka määrittää spektrimerkinnät: kvantinumerot
Kaikkiaan neljä kvantinumeroa käytetään kuvaamaan kokonaan kunkin elektronin liikkumista ja suuntauksia atomin sisällä.
Kaikkien atomin kaikkien elektronien kaikkien elektronien kvantinumeroiden yhdistelmä kuvataan aaltofunktiolla, joka täyttää Schrödinger -yhtälön. Jokaisella atomin elektronilla on ainutlaatuinen kvanttilukujoukko.
Se voi palvella sinua: molaarinen fraktio: miten se lasketaan, esimerkkejä, harjoituksiaPaulin syrjäytymisperiaatteen mukaan kahdella elektronilla ei ole samaa yhdistelmää neljästä kvanttiluvusta.
Kvanttinumerot ovat tärkeitä, koska niitä voidaan käyttää atomin elektronisen kokoonpanon ja atomielektronien todennäköisen sijainnin määrittämiseen.
Kvanttilukuja käytetään myös atomien muiden ominaisuuksien, kuten ionisaatioenergian ja atomien säteen, määrittämiseen.
Kvantinumerot nimeävät erityiset kuoret, alakortit, kiertoradat ja elektronit käännökset.
Tämä tarkoittaa, että ne kuvaavat kokonaan atomin elektronin ominaisuuksia, ts. He kuvaavat jokaista yksittäistä ratkaisua Schrödinger -yhtälöön tai aaltofunktioon, elektronit atomiin.
Kvanttimäärää on yhteensä neljä: pääkvanttiluku (n), kiertoradan kulman (L) kvanttinumero, magneettinen kvanttiluku (ml) ja elektronien spinin (MS) kvanttiluku (MS).
Tärkein kvanttiluku, NN, kuvaa elektronin energiaa ja ydinelektronin todennäköisimmän etäisyyden. Toisin sanoen se viittaa kiertoradan kokoon ja energiatasoon, johon elektroni sijoitetaan.
Alakulkujen lukumäärä tai LL kuvaa kiertoradan muotoa. Sitä voidaan käyttää myös kulmasolmujen lukumäärän määrittämiseen.
Magneettinen kvanttiluku, ML, kuvaa energiatasoja alakorussa ja viittaa enemmän elektronin spiniin, joka voi olla ylös tai alas.
Aufbaun periaate
Aufbau tulee saksalaisesta sanasta Aufbauen, Mitä "rakentaa" tarkoittaa. Pohjimmiltaan, kun kirjoitamme elektronikokoonpanoja, rakennamme elektronien kiertoratoja, kun etenemme atomista toiseen.
Kun kirjoitamme atomin elektronisen kokoonpanon, täytämme orbitaalit kasvavassa atomilukujärjestyksessä.
Aufbau -periaate on peräisin Paulin poissulkemisperiaatteesta, jonka mukaan atomisessa ei ole kahta fermiota (esimerkiksi elektronia).
Se voi palvella sinua: Butihappo: kaava, ominaisuudet, riskit ja käyttötarkoituksetHeillä voi olla sama kvanttilukujoukko, joten heidän on "kerättävä" korkeammalla energiatasolla. Kuinka elektronit kerääntyvät, on elektroniasetusten aihe.
Stabiililla atomeilla on yhtä monta elektronia kuin ytimessä. Elektronit kokoontuvat ytimen ympärille kvanttiorbitaaleilla neljää perussääntöä, nimeltään Aufbau -periaate.
1. Atomista ei ole kahta elektronia, jotka jakoivat samat neljä kvanttiluku N, L, M ja S.
2. Elektronit vievät ensin pienimmän energian tason kiertoradat.
3. Elektronit täyttävät orbitaalit aina samalla spin -numerolla. Kun orbitaalit ovat täynnä, se alkaa.
4. Elektronit täyttävät kiertoradat kvanttilukujen n ja l. Orbitaalit, joilla on yhtäläiset arvot (n + l), täytetään ensin alemmilla N -arvoilla.
Toinen ja neljäs säännöt ovat periaatteessa samat. Esimerkki säännöstä neljä olisi kiertorataa 2p ja 3s.
Orbital 2p on n = 2 ja l = 2 ja 3S kiertorata on n = 3 ja l = 1. (N + l) = 4 molemmissa tapauksissa, mutta 2p -kiertoradalla on alhaisin energia tai alhaisempi arvo ja se täytetään ennen kerrosta 3s.
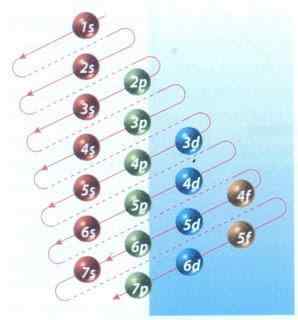 Kuva 2: Moeller -kaavio elektronisesta kokoonpanosta täyte
Kuva 2: Moeller -kaavio elektronisesta kokoonpanosta täyte Onneksi voit käyttää kuvassa 2 esitettyä Moeller -kaaviota elektronien täyttämiseen. Kaavio luetaan suorittamalla diagonaalit 1: stä.
Kuvio 2 esittää atomiorbitaalit ja nuolet osoittavat tavan seurata.
Nyt kun tiedetään, että orbitaalien järjestys on täytetty, ainoa jäljellä oleva asia on muistaa kunkin kiertoradan koko.
Orbitaaleilla on yksi mahdollinen arvo mlens Sisältää 2 elektronia
P -orbitaaleilla on 3 mahdollista arvoa mlens Sisältää 6 elektronia
Orbitaaleilla on 5 mahdollista arvoa mlens Sisältää 10 elektronia
F -orbitaaleilla on 7 mahdollista arvoalens Sisältää 14 elektronia
Tämä on kaikki mitä tarvitaan elementin vakaan atomin elektronisen kokoonpanon määrittämiseksi.
Voi palvella sinua: Dodecil -natriumsulfaatti (SDS): rakenne, ominaisuudet, käyttötarkoituksetOta esimerkiksi typpielementti. Typpellä on seitsemän protonia ja siksi seitsemän elektronia. Ensimmäinen täytettävä kiertorata on kiertorata 1s. Orbitaalilla on kaksi elektronia, joten jäljellä on viisi elektronia.
Seuraava kiertorata on 2S -kiertorata ja sisältää kaksi seuraavaa. Kolme viimeistä elektronia menee 2P -kiertoradalle, joka voi sisältää jopa kuusi elektronia.
Pesuallassäännöt
Aufbau -osassa keskusteltiin siitä, kuinka elektronit täyttävät ensin pienimmät energian kiertoradat ja siirtyvät sitten korkeimpiin energian kiertorauhaan vasta, kun alempienergiarbitaalit ovat täynnä.
Tässä säännössä on kuitenkin ongelma. Varmasti 1: n kiertoradalla on täytettävä ennen 2 s kiertorataa, koska 1: n kiertoradalla on alhaisempi arvo N, ja siksi alhaisempi energia.
Ja kolme erilaista kiertorataa? Missä järjestyksessä ne täytetään? Vastaus tähän kysymykseen liittyy pesuallasääntö.
Allas -sääntö osoittaa, että:
- Jokainen ala -tason kiertorata on miehitetty erikseen ennen kuin mikään kiertoradalla on kaksinkertaisesti miehitetty.
- Kaikilla yksilöllisesti miehitettyjen kiertoratojen elektronilla on sama käännös (kokonais käännöksen maksimoimiseksi).
Kun elektronit on osoitettu kiertoradalle, elektroni pyrkii ensin täyttämään kaikki kiertoradat samanlaisella energialla (jota kutsutaan myös rappeutuneiksi kiertoradoille) ennen sovittamista toiseen elektroniin puoliksi -täydellä kiertoradalla.
Maavaltioiden atomeissa on yleensä niin monta elektronia näkymätöntä kuin mahdollista. Kun visualisoitat tätä prosessia, harkitse, kuinka elektronit osoittavat saman käyttäytymisen kuin samat pylväät magneetissa, jos ne koskettavat.
Kun negatiivisesti varautuneet elektronit täyttävät orbitaalit, he yrittävät ensin päästä pois mahdollisimman paljon ennen kuin heidän on vastattava.
Viitteet
- Kvantinumerot. Chem.Librettexts.org.
- Elektronikokoonpanot ja atomien ominaisuudet (S.F.-A. Toipunut Oneontasta.Edu.
- Elektroninen kokoonpano. Toipunut Britannicasta.com.

