Rappeutuneet kiertoradat

- 3026
- 232
- Eddie Hackett
 Energiajärjestelmä puuttuvien elektronien käyttämien kiertoratojen kanssa. Lähde: Gabriel Bolívar
Energiajärjestelmä puuttuvien elektronien käyttämien kiertoratojen kanssa. Lähde: Gabriel Bolívar Se Rappeutuneet kiertoradat He ovat niitä, jotka löytyvät samalla energiatasolla. Tämän määritelmän mukaan heillä on oltava sama pääkvanttiluku n. Siten 2S- ja 2p -kiertoradat ovat rappeutuneet, koska ne kuuluvat energiatasoon 2, vaikka tiedetään, että niiden kulma- ja säteittäisten aaltojen toiminnot ovat erilaisia.
Kuten n, Elektronit alkavat miehittää muita energia -alatasoja, kuten D- ja F -orbitaalit.
Jokaisella näistä orbitaaleista on omat ominaisuutensa, joita ensi silmäyksellä havaitaan niiden kulmamuodoissa; Nämä ovat pallomaisia hahmoja, käsipainoja (p), apila -lehtiä (d) ja globaalia (f).
Niiden joukossa on energiaero, joka kuuluu jopa samalla tasolla n.
Esimerkiksi ylemmässä kuvassa esitetään energiajärjestelmä, jossa puuttuvat elektronit (epänormaali tapaus) käyttävät (epänormaali tapaus) (epänormaali tapaus).
Voidaan nähdä, että kaikista vakain (vähiten energia) on NS -kiertorata (1S, 2S, ...), kun taas NF on epävakaa (yksi, jolla on suurin energia).
Eristetyn atomin rappeutuneet orbitaalit
Rappeutuneet kiertoradat, samalla arvolla kuin n, Ne ovat samassa linjassa energiajärjestelmässä.
Tästä syystä Orbitals P: n symbolisoivat kolme punaista raidaa sijaitsevat samassa linjassa; kuten samalla tavalla purppura- ja keltaiset raidat.
Kuvajärjestelmä rikkoo pesuallas -sääntöä: Suuremman energian kiertoradat täytetään elektroneilla.
Voi palvella sinua: hapot ja emäkset: erot, ominaisuudet, esimerkitKun elektronit pariutuvat, kiertorata menettää energiaa ja käyttää suurempaa sähköstaattista torjuntaa muiden kiertoratojen puuttuviin elektroneihin.
Tällaisia vaikutuksia ei kuitenkaan oteta huomioon monissa energiakaavioissa. Jos näin on, ja noudattaa pesuallas -sääntöä täyttämättä kokonaan kiertorataa d, nähdään, että ne lakkaavat rappeutumisesta.
Kuten edellä todettiin, jokaisella kiertoradalla on omat ominaisuutensa. Eristetty atomi elektronisella kokoonpanollaan on halukas elektroniensa tarkkaan orbitaalien lukumäärään, joiden avulla he voivat isännöidä niitä.
Vain energiaa saavia voidaan pitää rappeutuneina.
Orbitaalit p
Kuvan kuvan kiertoradan kolme punainen raidaa osoittavat, että molemmat px, pja Ja pz -z Heillä on sama energia.
Jokaisessa katoaa elektroni, joka on kuvattu neljällä kvantinumerolla (n, lens, ml ja neiti), kun kolme ensimmäistä kuvaavat kiertorataa.
Ainoa ero niiden välillä merkitsee magneettinen hetki ml, joka vetää p: n etenemissuuntax X -akselilla, Pja Y -akselilla ja pz -z z -akselilla.
Nämä kolme ovat samat, mutta ne eroavat vain alueellisista suuntauksista. Tästä syystä ne vedetään aina energiaan, toisin sanoen rappeutuneita.
Samoin samat, inomotiivinen typpiatomi (1S -konfiguraatiolla22s22 p3) Sinun on pidettävä kolme kiertorataa rappeutuneena. Energiaskenaario muuttuu kuitenkin äkillisesti, jos sitä pidetään n: n atomista kemiallisessa molekyylissä tai yhdisteessä.
Se johtuu siitä, että vaikka px, pja Ja pz -z Ne ovat samoja energiassa, tämä voi vaihdella jokaisessa heistä, jos heillä on erilaisia kemiallisia ympäristöjä; Eli jos ne ovat yhteydessä eri atomiin.
Voi palvella sinua: isopreno: rakenne, ominaisuudet, sovelluksetOrbitaalit d
Viisi violetti raidaa merkitsevät orbitaalit d. Eristetyssä atomisessa, vaikka ne olisivat pariksi elektroneja, heidän katsotaan, että nämä viisi kiertorataa ovat rappeutuneet. Toisin kuin P -orbitaalit, tällä kertaa niiden kulmamuodoissa on huomattava ero.
Siksi heidän elektroniensa kulkevat avaruudessa olevat ohjeet, jotka vaihtelevat yhdestä kiertoradalla toiseen.
Tämä aiheuttaa Kiteinen kenttäteoria, että minimaalinen häiriö aiheuttaa a energian eteneminen orbitaalit; Eli viisi purppuran raidan erillistävät energiakuilun niiden välille:
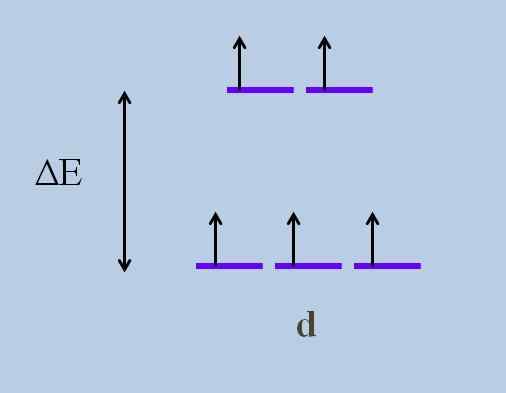 Orbitaalien energiankäyttöjärjestelmä. Lähde: Gabriel Bolívar
Orbitaalien energiankäyttöjärjestelmä. Lähde: Gabriel Bolívar Mitkä ovat yllä olevat kiertoradat ja jotka ovat alla olevat? Yllä olevat symboloidaan jag, ja alla olevat t2 g.
Huomaa, kuinka alun perin kaikki violetit raidat kohdistettiin, ja nyt muodostettiin kahden kiertoradan joukko jag enemmän energiaa kuin muut kolmen kiertoradan sarja t2 g.
Tämä teoria antaa selittää D-D-siirtymät, joihin monet siirtymämetallien yhdisteissä havaitut värit (CR, MN, usko jne.-A.
Tämä elektroninen häiriö johtuu metallikeskuksen koordinaatiovuorovaikutuksista muiden kutsuttujen molekyylien kanssa Ligandit.
Orbitaalit f
Ja kiertoratarf, seitsemän keltaista raitaa, tilanne on edelleen monimutkainen. Sen alueelliset osoitteet vaihtelevat suuresti niiden välillä, ja niiden linkkien visualisointi muuttuu liian monimutkaiseksi.
Itse asiassa katsotaan, että orbitaalit f ovat sellaisia sisäisiä kerroksia, että he eivät "osallistu huomattavasti" linkkien muodostumiseen.
Se voi palvella sinua: perkloorioksidi (CL2O7)Kun orbitaalien kanssa eristetty atomi ympäröi muut atomit, vuorovaikutukset alkavat ja aukeaminen tapahtuu (rappeutumisen menetys):
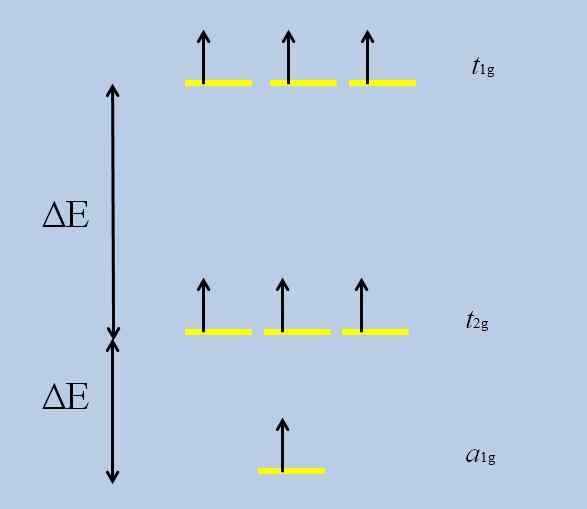 Rappeutumisen kaavio. Lähde: Gabriel Bolívar
Rappeutumisen kaavio. Lähde: Gabriel Bolívar Huomaa, että nyt keltaiset raidat muodostavat kolme sarjaa: t1G, t2 g ja -lla1G, Ja niitä ei enää hajoa.
Rappeutuneet hybridi -kiertoradat
On nähty, että orbitaalit voivat avata ja menettää rappeutumista. Vaikka tämä selittää elektroniset siirtymät, se ei selvennä kuinka ja miksi on erilaisia molekyyligeometriaja. Tässä hybridi -kiertoradat tulevat.
Sen pääpiirte on, että ne ovat rappeutuneita. Siten ne syntyvät kiertoradan S, P, D ja F seoksesta rappeutuneiden hybridien aiheuttamiseksi.
Esimerkiksi kolme p -kiertorataa sekoitetaan yhden S: n kanssa, jotta saadaan neljä SP -kiertorataa3. Kaikki SP -kiertoradat3 Ne ovat rappeutuneita, ja siksi niillä on sama energia.
Jos lisäksi kaksi kiertorataa sekoitetaan neljän SP: n kanssa3, Saadaan kuusi orbitaalia3d -d2.
Ja miten molekyyligeometriat selittävät? Koska niitä on kuusi, yhtä suuret energiat, niitä on siis ohjattava symmetrisesti tilassa tasaisten kemiallisten ympäristöjen tuottamiseksi (esimerkiksi MF -yhdisteessä6-A.
Kun he tekevät, muodostuu koordinaation oktaedroni, joka on yhtä suuri kuin oktaedrinen geometria keskuksen ympärillä (M).
Geometrioilla on kuitenkin yleensä vääristymiä, mikä tarkoittaa, että jopa hybridi -kiertoradat eivät ole täysin rappeutuneita.
Siksi johtopäätöksenä rappeutuneita kiertoratoja esiintyy vain eristetyissä atomeissa tai erittäin symmetrisissä ympäristöissä.
Viitteet
- Määritelmä Degerate. Toipunut: Chemicool.com
- Atomit ja atomien kiertoradat. Toipunut sparknotista.com
- Whitten, Davis, Peck & Stanley. Kemia. (8.ª Ed.-A. Cengage -oppiminen.

