Pepsinogeenirakenne, toiminnot, tyypit, synteesi
- 3185
- 710
- Dr. Travis Reichert
Hän Pepsinogeeni Se on pepsiinin zimogeeni, yksi tärkeimmistä hydrolyyttisistä entsyymeistä, jotka ovat vastuussa proteiinien sulamisen suorittamisesta nisäkkäiden vatsassa. Zimogeenit tai proentsyymit ovat inaktiivisia entsymaattisia esiasteita, ts. He eivät pysty katalysoimaan aktiivisten muotojen toteuttamia reaktioita.
Sen aktivointi riippuu muutoksista proteiinin kolmenulotteisen rakenteessa, jotka aiheuttavat funktionaalisen aktiivisen kohdan muodostumisen. Nämä muutokset ovat useimmissa tapauksissa samaan aikaan kuin proteiinisegmentin proteolyyttinen repeämä.
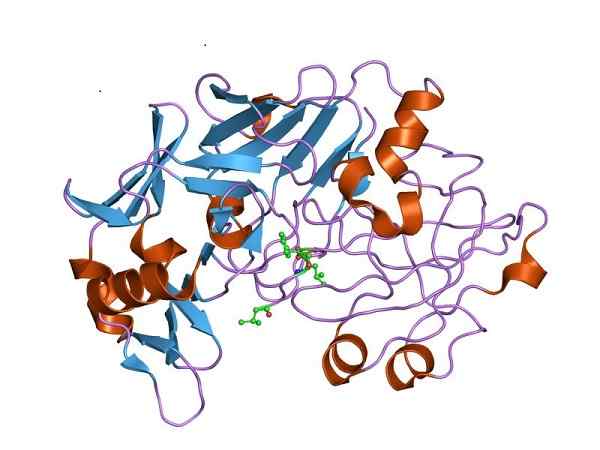
 Pepsiinin kolmen dimensioinen rakenne, pepsinogeenin katalyyttisesti aktiivinen muoto. Kirjoittanut Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons
Pepsiinin kolmen dimensioinen rakenne, pepsinogeenin katalyyttisesti aktiivinen muoto. Kirjoittanut Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons Siksi pepsinogeenin on koettava rakenteelliset muutokset vaaditun peptidaasiaktiivisuuden hankkimiseksi ja proteiinien sulamisen edistämiseksi vatsassa ruoan saannin jälkeen.
[TOC]
Rakenne
Pepsinogeeni on 371 aminohappoproteiini, joka kuuluu asparatic -proteinaasien suureen perheeseen, jolle on ominaista esitellä asparagiinihappotähteitä sen aktiivisessa keskuksessa.
Sen kvaternäärinen rakenne määritettiin ensimmäistä kertaa sioissa ekspressoidulle proteiinille x -gray -kristallografiatekniikan avulla. Tulos oli samanlainen kuin proteiinin, pepsiinin kypsän tai aktiivisen muodon osoittama.
Siten ainoa havaittu ero on 44 aminohappopeptidin pepsinogeenin läsnäolo, joka taittuu aktiivisen kohdan raon yli. Tässä asennossa se estää tämän proteaasin vuorovaikutusta proteiinien kanssa hajoamiseksi.
Tämä peptidi, joka pukeaa aktiivisen entsyymin aikaansaamiseksi, sijaitsee proteiinin amino -päätelaitteessa.
Koska se toimii vain korkkina, hajoteproteiinipropsinogeenin kyvyttömyys ei johdu aktiivisen keskuksen rakenteellisista muodonmuutoksista. Päinvastoin, tämä pysyy samalla konformaatiolla entsyymin molemmissa muodoissa.
Voi palvella sinua: glucanit: rakenne, ominaisuudet ja toiminnotTässä mielessä on syytä huomata, että pepsinogeenin kiderakenne on likimääräinen malli muiden asparatifien suureen perheeseen kuuluvien zimogenosten rakenteesta.
Funktiot
Elämän alussa pepsiini (pepsinogeenin aktiivinen muoto) on tärkeä maidon sulamiselle. Myöhemmin sen tehtävänä on hajottaa ruokavalioproteiinit niiden aineosissa (aminohapot) niiden helpon imeytymisen helpottamiseksi.
Synteesi ja eritys
Pepsinogeenin syntetisoivat mahalaukun limakalvot ja perussolut. Myöhemmin se säilytetään eritysvesikkeleissä, jotka pysyvät näiden solujen sytoplasmassa siihen hetkeen, jolloin niiden vapautuminen vaaditaan.
Siksi tämän zimogeenin eritys on prosessi, jota säännellään. Sen vesikkelien vapautuminen, sytosolin asukkaat eksosytoosin kautta, vaatii hormonaalisia ja hermostimulaatioita. Mahka -entsyymien tasojen nousu erillään ja mahalaukussa, samoin kuin asetyylikoliini, kolekystokiniini, epidermaalinen kasvutekijä ja typpioksidi stimuloivat niiden synteesiä ja eritystä.
Lisäksi ATT20 -solujen kanssa tehdyt kokeet, jotka ovat yleisesti nisäkkäiden eritysten tutkimuksessa käytettyjä solulinjaa, ovat osoittaneet, että syklisen AMP: n lisääntyminen kykenee myös indusoimaan tällaisen erityksen.
Vatsan tasolla normaalin erityksen lisäksi sekä veressä että virtsassa on havaittu suhteellisen pieni määrä pepsinogeenia, minkä vuoksi sitä on kutsuttu uropepsinogeeniksi.
Uropepsinogeenin alkuperä, samoin kuin toiminto, jonka se voi suorittaa molemmissa paikoissa, on edelleen määritetty. Heidän puuttumisensa potilailla, jotka ovat täysin poistaneet vatsan, näyttää kuitenkin osoittavan, että heidän alkuperänsä on yhtä vatsaa.
Kaverit
Tähän mennessä on kuvattu kahta päätyyppiä pepsinogeeni: pepsinogeeni I ja pepsinogeeni II. Molemmilla tyypeillä ei ole eroja niiden katalyyttisessä aktiivisuudessa ja aktivoidaan tasaisesti proteolyyttisellä hydrolyysillä, joka riippuu suolahaposta.
Voi palvella sinua: Proteiinin denaturointi: Mikä on, tekijät, seurauksetPepsinogeeni I syntetisoivat ja erottelevat sekä päähin limakalvojen pääkennoilla. Siksi sen eritys vähenee potilailla, joilla on atrofinen krooninen gastriitti, mahasairaus, jolle on ominaista mahalaukun kokona.
Toisin kuin jälkimmäinen, pepsinogeeni II (PGII) syntetisoivat käytännössä kaikki solut, jotka ovat osa mahalaukun limakalvoa, mutta näkyvämmin antral limakalvon solujen ja dubenumissa olevien rauhasten muodostavien solujen soluissa.
Potilailla, joilla on atrofinen krooninen gastriitti, tämäntyyppinen pepsinogeeni kompensoi pepsinogeenin erityksen vähentymisen I.
Näiden kahden pepsinogeentyypin olemassaolo, jotka eroavat vain erillään erillisistä, saattaa tuntua tarpeettomalta. Se voi kuitenkin olla evoluutio -sopeutuminen pepsiinisynteesin takaamiseksi tarvittaessa.
Aktivointi
Pepsinogeeni saa katalyyttistä aktiivisuutta, kun se muuttuu pepsiiniksi, aktiivisen kohdan ontelon 44 aminohappopeptidin eliminoinnin tuote.
Sen optimaalinen toiminta riippuu alhaisista pH -arvoista, jotka sisältyvät alueelle 1,5 - 2. Fysiologisissa olosuhteissa näitä arvoja ylläpitää suolahapon eritys solunsisäisillä kanavilla.
Happohuoansulatus mahalaukun tasolla ei tapahdu kaikissa eläimissä. Esimerkki tästä ovat hyönteisiä, joilla ei ole pepsinogeenia. Selkärankaiset, joilla on vatsa, jos heillä on peptinen aktiivisuus.
Pepsinogeeni, joka säilytetään pääsolujen eritysvesikkeleissä, vapautuu tarvittaessa mahalaukun kanavalle. Kun se saavuttaa vatsan, siitä tulee happaman ympäristön pepsiinituote ja tästä aktiivisemmasta pepsinogeenisestä molekyylistä.
Sisäisten hermokuitujen ja vagalin ulkoisen stimulaation vaikutuksella stimuloidaan, samoin kuin HCl, gastriini ja histamiini. Toisaalta histamiini ja maha stimuloivat parietaalisoluja HCL: n erittämiseksi.
Voi palvella sinua: Johtavat kankaat: Mikä on, ominaisuudet, toiminnotPepsiini, kuten kaikki endopeptidaasi, vaikuttaa spesifisiin yhteyksiin proteiiniaminohappojen välillä pienempien peptidien tuottamiseksi.
Toisin sanoen; Hydrolysoi proteiinin sisäisiä peptidisidoksia. Sen vaikutus on tehokkaampi peptidilinkeissä lähellä aromaattisia aminohappoja (fenyylialaniini, tyrosiini). Toisin kuin sen edeltäjä zimogeeni, pepsiinin mukautuvat muutokset yli 6: n pH -arvoissa tuottavat peruuttamattoman katalyyttisen aktiivisuuden heikkenemisen.
Viitteet
- Bryksa BC, Tanaka T, Yada Ry. N-terminaalinen modifikaatio lisää pepsiinin neutraali-ph-stabiilisuutta. Biokemia. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Happamien protessan primaarirakenteiden ja niiden symogeenien vertailu. Adv Exp Med Biol. 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Lääketieteellisen fisiologian oppikirja. (11. ed.-A. USA: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, sisätautien periaatteet. (16. ed.-A. Meksiko: McGrawhill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Vakava atrofinen gastriitti Helicobacter pylori -infektiolla ja mahalaukun syöpään. Mahasyöpä. 1998; 1: 118-124.
- Lin Y, löydetty M, Lin X, Hartsuck JA, Tang J. Pepsiinin, rhizopuspepsinin ja niiden aktiivisen paikan vety sidosmutanttien kineettisten parametrien pH-riippuvuus. J Biol Chem. 1992; 267: 18413-18418.
- Mangeat p. Happojen eritys ja kalvojen uudelleenjärjestely yksittäisen mahalaukun parietaalisoluissa primaariviljelmässä. Biologinen solu. 1990; 69: 223-257.
- Prozialeck J, Wershil BK. (2017). Mahalaukun eritystoiminnon kehittäminen. Sikiön ja vastasyntyneen fysiologia (viides painos). Volume 1, sivut 881-888.
- Schubert ML. Mahalaukun salaisuus. Nykyinen IND Gastroent 2005; 21: 633-757.
- Siilecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James Mng. Monokliinisen sian pepsiinin molekyyli- ja kiderakenteet puhdistettiin 1.8 Å -resoluutio. J Mol Biol. 1990; 214: 143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, vanhin JB. Matalan seerumin pepsinogeenin A -tasojen epidemiologia ja kansainvälinen yhteys mahalaukun syöpään kanssa. Gastroenterologia. 1994; 107: 1335-1344.
- Wolfe MM, Soll Ah. Mahahapon salaisuuden fysiologia. N English J Med 1998; 319: 1707.
- « G -solujen kehitys, maha-, turvekymppiset kanavat
- Nanche -ominaisuudet, elinympäristö, ominaisuudet, ruoanlaittoreseptit »

