Pyridiinirakenne, ominaisuudet, käytöt, toksisuus, synteesi
- 3510
- 1129
- Sheldon Kuhn
Se Pyridiini Se on aromaattinen amiinia, jonka kemiallinen kaava on c5H5N. Se on bentseenin typpiversio ryhmänä -CH = on korvattu typpiatomilla (n). Yhdessä pyrolin kanssa pyridiini muodostaa ryhmän kaikkien yksinkertaisempien aromaattisten amiinien kanssa.
Alun perin pyridiini tapahtui hulla -tervasta, mutta se oli pieni suorituskykymenetelmä. Tämä johti useiden menetelmien luomiseen sen kemialliselle synteesille, joka vallitsi sen, jossa käytetään formaldehydin, asetaldehydin ja ammoniakin reaktiota.
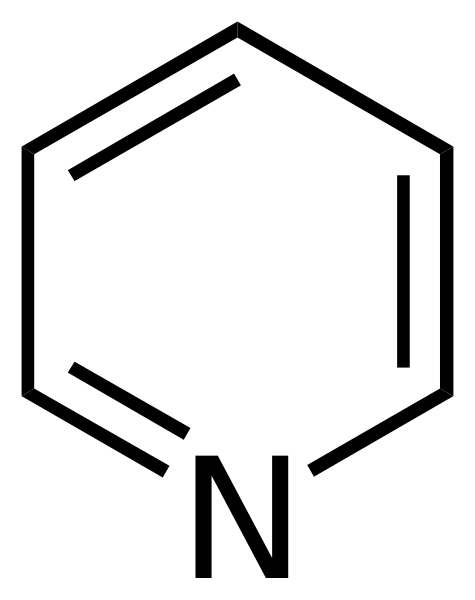 Pyridiinin rakennekaava. Lähde: Calvero. / Julkinen alue
Pyridiinin rakennekaava. Lähde: Calvero. / Julkinen alue Pyridiini sai ensimmäistä kertaa Thomas Anderson (1843), kemisti esittelee, jotka eläinlihan ja luiden lämmityksen kautta tuottivat öljyn, josta pyridiini puhdistettiin.
 Thomas Anderson (heinäkuu 1819)
Thomas Anderson (heinäkuu 1819) Pyridiiniä käytetään raaka -aineena yhdisteiden synteesissä, jotka eliminoivat ja hallitsevat hyönteisten, sienten, yrttien jne. Proliferaatiota, jne. Sitä käytetään myös lukuisten lääkkeiden ja vitamiinien kehittämisessä, sen lisäksi, että sitä käytetään liuottimena.
Pyridiini on myrkyllinen yhdiste, joka voi kroonisesti vaurioita maksalle, munuaisille ja keskushermoston toiminnalle. Pyridiini voi tulla kehoon nauttimisen, hengittämisen ja leviämisen vuoksi ihon läpi. Se tunnetaan kemikaalissa, koska se on aine, joka kykenee aiheuttamaan avuttomuutta miehillä.
[TOC]
Pyridiinirakenne
Molekyyli-
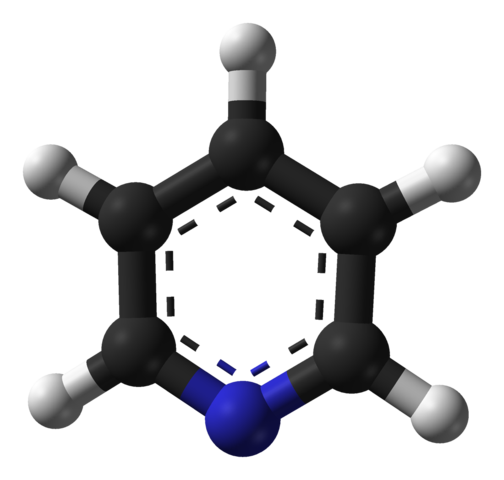 Pyridiinin molekyylirakenne. Lähde: Benjah-BMM27 / julkinen verkkotunnus
Pyridiinin molekyylirakenne. Lähde: Benjah-BMM27 / julkinen verkkotunnus Ylivoimainen kuva näyttää pyridiinin molekyylirakenteen, jota edustaa pallo- ja tankojen malli. Kuten voidaan nähdä, sen molekyyli on hyvin samanlainen kuin bentseenin, ja sillä on ainoa ero, että siinä on yksi hiilistä (mustat pallot), jotka on korvattu typellä (sininen pallo).
Typpi, koska se on elektronegatiivisempi, houkuttelee elektronista tiheyttä itseään kohtaan, joka luo pysyvän dipolimomentin pyridiinissä. Siksi pyridiinimolekyylit ovat vuorovaikutuksessa dipoli-dipolovoimien kautta.
Vetyatomit ovat elektronien köyhimmät alueet, niin että ne suuntautuvat naapurimolekyylin typpiatomin suuntaan.
Kiteinen
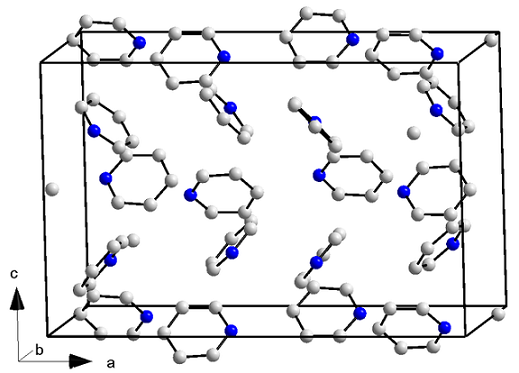
 Pyridiinin kiteinen rakenne. Lähde: ORCI/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Pyridiinin kiteinen rakenne. Lähde: ORCI/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Pyridiinimolekyyleissä ei ole vain dipoli-dipolovoimia, vaan myös aromaattisten renkaiden vuorovaikutuksia. Siten nämä molekyylit onnistuvat asettamaan itsensä järjestäytyneeksi aiheuttamaan ortorromisen rakenteen kide (ylempi kuva) lämpötilassa -41,6 ° C.
Pyridiiniominaisuudet
 Pyridiininäyte. LHCHEM/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Pyridiininäyte. LHCHEM/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Fyysinen ulkonäkö
Väritön neste, tunkeutuva haju, samanlainen kuin kalat.
Voi palvella sinua: Redox -tasapainomenetelmä: vaiheet, esimerkit, harjoituksetMoolimassa
79,1 g/mol
Tiheys
0,9819 g/ml
Sulamispiste
-41,6 ºC
Kiehumispiste
115,2 ºC
Liukoisuus
Se sekoittuu veden kanssa ja myös alkoholin, eetterin, öljyeetterin, öljyjen ja monien orgaanisten nesteiden kanssa.
Höyrynpaine
16 mmHg 20 ° C: ssa.
Höyryn tiheys
2,72 suhteessa veteen = 1
Taittumisindeksi (nD -d-A
1 5093
Goo
0,88 CP
Dipolaarinen hetki
2,2 d
sytytyspiste
21 ºC
Itsenistuneen lämpötila
482 ºC
Hajoaminen
Hajoamiseen lämmitettyä säteilee syanidin savua.
Korroosio
Pyridiini nestemäisessä muodossa hyökkää joitain muovien, kuppien ja pinnoitteiden muotoja.
PHE
8,5 (0,2 M liuos vedessä)
Emäksisyys ja reaktiivisuus
Pyridiini on heikko emäs. Se on tertiäärinen amiini, jonka 0,2 M -liuos vedessä tuottaa pH: n 8,5. Sillä on vähän affiniteettia typpielektronegatiivisuuden vuoksi elektroneihin, joten niiden hiilit eivät yleensä kärsi elektrofiilisestä substituutiosta.
Pyridiini kokee nukleofiilistä substituutiota, edullisesti asemissa c4 ja c2 Renkaasta. Pyridiini on enemmän kuin bentseeni ja reagoi väkivaltaisesti rikkihapon, typpihapon ja anhydridin kanssa, koska kykynsä luovuttaa elektroneja, pyridiini on enemmän hapettumista.
Pyridiinin käyttö
Torjunta -aineet
Pyridiini on etu- ja diquat -rikkakasvien torjunta -aineiden edeltäjä. Samalla tavalla se palvelee kloorifos -hyönteismyrkkyn synteesiä, jonka alkuvaihe on pyridiinin klooraus. Se on myös alkuperäinen raaka -aine, joka saa pyrkimyksen perusteella sienitautien torjunta -aineen.
Liuotin
Pyridiini on polaarinen liuotin, jota käytetään jälleenmyyjien reaktioihin ja antibioottien uuttamiseen. Pyridiiniä käytetään liuottimena maali- ja kumiteollisuudessa ja myös tutkimuslaboratorioissa liuottimena kasvihormonien uuttamisessa.
Lääke
Pyridiini toimii alkuperäisenä pisteenä setilpyridiniumin ja laurilpyridiniumin synteesissä, yhdisteinä, joita käytetään antiseptikoina suun ja hammashoitotuotteissa. Pyridiinimolekyyli on osa lukuisten lääkkeiden kemiallista rakennetta.
Esimerkiksi esmepratsoli, jota käytetään gastroesofageaalisen refluksin hoidossa. Loratidiini on toinen pyridiiniin perustuva lääke, joka tunnetaan nimellä klaritiini, jota käytetään allergisten prosessien käsittelynä.
Pyridiiniä (fenatsopyridiini) -tabletteja käytetään virtsateiden ärsytyksen oireellisessa hoidossa, johon liittyy joissain tapauksissa kipu, polttaminen ja virtsauksen kiireellisyys. Fenatsopyridiini on väriaine, joka täyttää kipulääkefunktion virtsatiessa.
Di-asyylhidratsiini on pyridiinijohdannainen, jolla on antibakteerinen aktiivisuus, joka käyttää gram-negatiivisia bakteereja, kuten JA. koli, ja grampositiiviset bakteerit, kuten S. Albus.
Pyridiini toimii perustana tiatsolo [5,4-6] pyridiinille, joka koostuu viruksenvastaisesta aktiivisuudesta, etenkin influenssan β-massan virusta vastaan. 2-asetyylipyridiinillä, pyridiinijohdannaisella, on suuri antituumorin aktiivisuus ja se on leukemia-estäjä.
Voi palvella sinua: Elohopeaoksidi (HG2O)Toiset
Pyridiiniä käytetään vitamiinien, kumituotteiden, liimojen, maalauksien ja hyönteismyrkkyjen valmistuksessa. Sitä käytetään myös alkoholin denaturoinnissa ja joidenkin tekstiilien värjäyksessä.
20 % pyridiinistä käytetään piperidiinin valmistuksessa. Piperidiini puuttuu vulkanoitumiseen ja maatalouteen.
Pyridiiniä käytetään myös polykarbonoitujen hartsien synteesissä elintarvikemakuina ja syanidin havaitsemisen reagenssina.
Myrkyllisyys
- Pyridiini tulee organismiin pääasiassa hengitystä ja diffuusiosta ihon läpi. Akuutti altistuminen pyridiinille voi aiheuttaa ärsytystä ja silmien ja ihon palovammoja.
- Pyridiini voi olla peräisin ihon ihottumasta ja allergiasta. Allergian kehitykseen voidaan seurata kutinan ja ihottuman lisäksi.
- Pyridiinin hengitys voi aiheuttaa nenän ja kurkun ärsytystä, johon liittyy yskä ja astmaattinen hengitys.
- Nielemällä pyridiini voi aiheuttaa pahoinvointia, oksentelua, ripulia ja vatsakipuja. Samoin suuren annoksen pyridiiniannoksen sisällyttäminen organismiin voi aiheuttaa: päänsärky, väsymys, haalistuva, upea, huimaus, sekavuus ja lopulta syöminen ja kuolema.
- Pyridiinin vaikutuksen eniten vaikuttavat elimet ovat maksa, munuaiset, miesten sukupuolielimet ja keskushermosto. Se voi toimia myös luuytimessä, indusoimalla verihiutaleiden tuotantoa. Pyridiinin karsinogeenistä vaikutusta ei ole todistettu eläimissä.
OSHA perusti altistumisen ilmassa 5 ppm / 8 tunnin työpäivä.
Synteesi
Ensimmäiset pyridiinin saamismenetelmät perustuivat sen louhintaan orgaanisia materiaaleja. Thomas Anderson (1843) sai ensimmäistä kertaa pyridiiniä lämmittämällä lihaa ja eläinluita. Ensimmäisessä vaiheessa Anderson tuotti öljyn, josta hän onnistui tislaamaan pyridiinin.
Perinteisesti pyridiini saatiin hulla -terva- tai hiilen kaasutuksesta. Nämä toimenpiteet olivat hankalia ja vähän suorituskykyä, koska pyridiinin pitoisuus näissä raaka -aineissa oli erittäin alhainen. Synteesimenetelmä oli välttämätön.
Chichibabin -menetelmä
Vaikka pyridiinisynteesille on monia menetelmiä, vuonna 1923 otettua chichibabin -menettelyä käytetään edelleen pääasiassa. Tässä menetelmässä pyridiini syntetisoidaan formaldehydin, asetaldehydin ja ammoniakin reaktiosta, jotka ovat halpoja reagensseja.
Voi palvella sinua: 02 -linkin tyyppiEnsimmäisessä vaiheessa formaldehydi ja asetaldehydi reagoivat akroleiiniyhdisteen muodostamiseen knoevegelin kondensaatioreaktiossa, muodostaen myös vettä.
 Akroleínan ja asetaldehydin pyridiinikondensaatio
Akroleínan ja asetaldehydin pyridiinikondensaatio Lopuksi, toisessa vaiheessa, Acroleína reagoi formaldehydin ja ammoniakin kanssa dihydropyridiinin muodostamiseksi. Myöhemmin dihydropyridiini hapettuu pyridiiniksi reaktiossa lämpötilassa 350-550 ° C kiinteän katalyytin, esimerkiksi piidioksidi -aluminan läsnä ollessa.
Reaktiot
Elektrofyyliset substituutiot
Nämä substituutiot eivät yleensä tapahdu alhaisen elektronisen pyridiinitiheyden vuoksi.
Sulfanaatio aiheuttaa suurempia vaikeuksia kuin nitraatio. Mutta bromaatio ja klooraus tapahtuu helpommin.
Pyridiini-n-oksidi
Pyridiinin hapettumiskohta on typpiatomi, joka on persikoiden tuottama hapettuminen (hapot, joilla on OOH -ryhmä). Typen hapettuminen edistää elektrofiilistä substituutiota pyridiinin hiilihiilissä 2 ja 4.
Nukleofiiliset substituutiot
Pyridiini voi kokea useita nukleofiilisiä substituutioita pyridiinirenkaan alhaisen elektronisen tiheyden vuoksi. Nämä substituutiot esiintyvät helpommin pyridiinimolekyylissä, joka on modifioitu bromilla, kloorilla, fluorilla tai sulfonihapolla.
Nukleofiiliset hyökkäykset pyridiiniin liittyvät yhdisteet ovat yleensä: alkoholidit, tayolaatit, amiini ja ammoniakki.
Radikaalireaktiot
Pyridiini voidaan tyhjentää radikaaleilla reaktioilla. Radikaali pyridiinin dimeroituminen suoritetaan alkuaineen natriumilla tai nikkelillä, sillä se pystyy tuottamaan 4,4'-bipperidiiniä tai 2,2'-bipperidiiniä.
Reaktio typpiatomiin
Hapot, Lewisin mukaan, lisätään helposti pyridiinin typpiatomiin, muodostaen pyridiinisuoloja. Pyridiini on Lewis -pohja, joka lahjoittaa pari elektronia.
Hydraus- ja pelkistysreaktio
Piperidiini tuotetaan pyridiinin hydrauksella nikkelillä, koboltilla tai ruteniumilla. Tämä reaktio tehdään korkeissa lämpötiloissa, joihin liittyy katalyytin käyttö.
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10th Painos.-A. Wiley Plus.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Morrison ja Boyd. (1987). Orgaaninen kemia. (Viides painos). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Pyridiini. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2020). Pyridiini. Pubchem -tietokanta., CID = 1049. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Laura Foist. (2020). Pyridiini: rakenne, kaava ja fysikaaliset ominaisuudet. Opiskelu. Toipunut: Opiskelu.com
- Atof Ali Altaf, Adnan Shahzad, Zarif Gul, Nasir Rasool, Amin Badshah, Bhajan Lal, Ezzat Khan. (2015). Katsaus pyridiinijohdannaisten lääketieteellisestä merkityksestä. Lehti lääkkeen suunnittelusta ja lääkekemiasta. Osa. 1, ei. 1, pp. 1-11. Doi: 10.11648/j.JDDMC.20150101.yksitoista
- Webmd. (2020). Pyridiinitabletti. Haettu: WebMD.com
- New Jerseyn terveys- ja vanhempien palvelujen laitos. (2002). Pyridiini. [PDF]. Palautettu: NJ.Hallitus
- « C ++ Historia, ominaisuudet, tietotyypit, esimerkit
- Välttämättömät rasvahappojen toiminnot, merkitys, nimikkeistö, esimerkit »

