Potentiometrian perusteet, yhtälöt, elektrodit

- 4287
- 898
- Shawn Stanton II
Se Potentiometria Se on sähkökemiallinen analyysitekniikka, joka perustuu väliaineen tai osaston jännitteen mittaukseen, jonka kanssa määritetään lajin (ioninen tai molekyyli) aktiivisuus tai pitoisuus (ioninen tai molekyyli). Se on ei -hallitseva tekniikka, koska se ei pyritä muuttamaan kyseisen analyytin kemiallista luonnetta.
Tämän analyysin suorittamiseksi ainakin kaksi elektrodia on välttämätöntä: toinen viitekappale ja toinen indikaattori tai työ. Samoin on oltava korkea impedanssin volttimittari, jonka kanssa jännitteet mitataan sallimalla huomattavaa elektronivirtausta kahden elektrodin ja niitä ympäröivien liuosten välillä.
 Tarvittavien elementtien yleinen esitys potentiometriseen analyysiin. Lähde: Gabriel Bolívar.
Tarvittavien elementtien yleinen esitys potentiometriseen analyysiin. Lähde: Gabriel Bolívar. Yllä on yleinen esitys kokoonpanosta potentiometriseen analyysiin. Osastossa, jossa indikaattorielektrodi otetaan käyttöön, on laji, jonka pitoisuus haluamme määrittää; Vertailuelektrodissa meillä on toinen ratkaisu, jossa tiedämme sen komponenttien pitoisuudet.
Rekisteröity jännitteen lukeminen johtuu periaatteessa indikaattorielektrodia lähestyvälle kiinnostavalle lajille. Tällä jännitteellä lasketaan tämän lajin pitoisuus, esimerkiksi Ca -ionien pitoisuus2+, Ag+, H+, Naa+, K -k -+, Cl-, jne. Potentiometrialla on siis käyttötarkoituksia kliinisessä, ympäristö-, analyyttisessä ja fysikaalis -kemiallisessa kemiassa.
[TOC]
Perusteet
Jännite, joka määritetään potentiometrisissä analyyseissä, on solun jasolu, Mikä on ero kahden elektrodin, indikaattorin ja referenssin aiheuttamien jännitteiden välillä. Elektrodit ovat herkkiä niitä ympäröivien molekyylien tai ionien aktiivisuudelle, kykenemättä hyväksymään niiden elektroneja tai päinvastoin.
Kaksi osastoa on kytketty, joten elektrodielektrodi virtaa pelkistyksen tapahtuessa (katodi) elektrodiin, jossa hapetus (anodi) tapahtuu (anodi).
Tämä elektronien (tai virran) siirto on kuitenkin melkein nolla, koska muuten redox -reaktiot muuttuisivat muuttamaan kokonaan mukana olevien lajien pitoisuuksia ja identiteettejä.
Voi palvella sinua: vetybromidi (HBR)Sen sijaan volttimittari tuskin sallii elektronien kulkemisen siten, että jännitteen lukema on stabiili ja että solu voi saavuttaa termodynaamisen tasapainon.
Siksi sanotaan, että potentiometria on ei -hallitseva tekniikka, koska harvat ionit tai molekyylit muuttuvat mittausprosessiin, mikä on myös palautuvaa.
Pääyhtälöt
Solupotentiaali
Solun potentiaali liittyy kiinnostavien lajien aktiivisuuksiin tai pitoisuuksiin Nernst -yhtälön kautta:
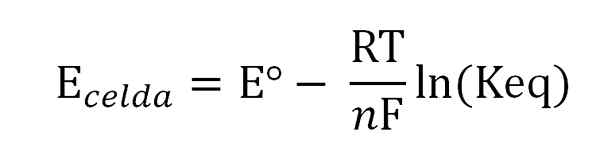 Nernst -yhtälö. Lähde: Gabriel Bolívar.
Nernst -yhtälö. Lähde: Gabriel Bolívar. Missä Eº on saman solun potentiaali vakioolosuhteissa, f Faraday -vakio, n Siirrettyjen elektronien lukumäärä, r kaasuvakio ja keq globaalin reaktion tasapainovakio. Laskelmat tehdään tyhjentämällä Keq E: n lukemisestasolu, ja tasapainoilmaisun halutun pitoisuuden laskeminen.
On kuitenkin kätevää laskea pitoisuudet helpommalla reitillä. Yleissopimuksen mukaan solun potentiaali annetaan myös seuraavalla yhtälöllä:
JAsolu = Eruudukko- JAhärkä
Missä Eruudukko Se on potentiaali pelkistykselle puoliksi -media, jossa indikaattorielektrodi sijaitsee; kun taas Ehärkä Se on potentiaali hapettumisen puoliksi -medialle, jossa meillä on referenssielektrodi. Siten yhtälö voidaan kirjoittaa uudelleen:
JAsolu = Eindikaattori - JAviite + JAJ -
E -eJ - Yhdenmukainen nivelsiirtojen aiheuttama potentiaali. Käytännössä jaJ - Sitä ei voida määrittää, mutta varmista, että sen arvo on mahdollisimman vähän käyttämällä hyvin laimennettuja liuottoja tai varmistamalla, että molempien osastojen koostumukset ovat samanlaisia.
Analyytin potentiaali
Edellisestä yhtälöstä voimme laskea jaindikaattori, Mikä on potentiaali, joka todella kiinnostaa meitä. Tällä arvolla käytämme Nernst -yhtälöä uudelleen:
Voi palvella sinua: asetonitriili (C2H3N)JAindikaattori = Eº - (rt/nf) ln (punainen/härkä)
Verkko on analyytin tai kiinnostavan lajin vähentynyt muoto, ja OX on sen hapettunut muoto. Olettaen, että analyytti on kationit Zn2+ Metallisella sinkkielektrodilla meillä olisi:
JAindikaattori = EºZn2+/Zn - (Rt/nf) ln (1/-llaZn2+-A
Missä -llaZn2+ Se on Zn -kationiaktiivisuus2+, joka kokeellisilla säädöillä on melko lähellä sen pitoisuutta, [Zn2+-. Tästä yhtälöstä Zn -pitoisuus puhdistetaan2+, Se, kuten voidaan nähdä, vaikuttaa suoraan E: n arvoonindikaattori.
Sinkin vähentynyt muoto, Zn, on aktiivisuus yhtä suuri kuin 1. Siksi elektrodina toimivan metallin ruosteisten kationien yleinen yhtälö on yhtä suuri kuin:
JAindikaattori = EºMn+/m - (Rt/nf) ln (1/-llaM+n-A
Mutta tämä pätee vain ensimmäisen lajin elektrodien tapauksessa.
Elektrodit
Voltimetrin lisäksi elektrodit ovat kaikkien potentiometristen analyysien tärkeimmät elementit. Jotkut heistä mainitaan alla.
Ensimmäiset lajit
Ensimmäiset lajielektrodit ovat metalleja, jotka hapetut aiheuttavat kationeja, johtaen elektroneja volttimittariin. Jotkut näistä ovat seuraavia: AG, Zn, Cu, Hg, Sn, TL, CD ja BI.
Kaikki metallit eivät toimi ensimmäisen luokan elektrodina, koska niillä ei pitäisi olla kiteisiä epäsäännöllisyyksiä tai oksidikerroksia peittäviä pintoja, jotka aiheuttavat epävakaita jännitteitä.
Toinen laji
Toisaalta toisen laji -elektrodit ovat myös metallisia, mutta ne sisältävät myös suolan pinnalla, jonka liukoisuus riippuu tapahtuneista redox -reaktioista. Esimerkiksi AG-AGCL- ja HG-HG-elektrodit2Cl2 (Calomel), ovat toisen lajin elektrodit.
Valikoivat ionit
Selektiiviset ionielektrodit, jotka tunnetaan myös nimellä membraaneja, ovat ne, jotka ovat herkkiä tietylle ionille tai molekyylille, joka hiipii vain hänen ohittamaansa, jota ei ole suunniteltu, eikä muille liuoksessa oleville lajeille, jotka eivät ole muita lajeja, ei.
Voi palvella sinua: rajoittaminen ja liiallinen reagenssiTämän tyyppisen elektrodin suosikki esimerkki on lasi, joka on rakennettu H -ionien pitoisuuden määrittämiseksi3JOMPIKUMPI+ tai h+, Ja toimi siten pehometrinä.
Potentiometriasovellus
Ympäristön kemia
Potentiometriaa on käytetty ympäristökemiassa CN -ionien määrittämisessä-, F- ja ei3-, samoin kuin vesivirtojen ammoniakki.
Kliininen kemia
Selektiiviset elektrodit ovat erittäin hyödyllisiä, kun mittausväliaine on monimutkainen. Siksi muut ionit tai molekyylit häiritsevät lukemia.
Tämä ominaisuus on erityisen hyödyllinen samoissa soluissa suoritetuissa potentiometrisissä määrityksissä, joissa injektoidaan mikroelektrodit K K -pitoisuuksien määrittämiseksi+, Naa+, Cl-, Ac2+ tai h+.
Potentiometriset asteet
Oletetaan, että keskellä, jossa meillä on indikaattorielektrodi, lisätään otsikko, joka reagoi analyytin kanssa, ja siksi se muuttaa sen pitoisuutta. Sitten muutoksia tapahtuu E: ssäsolu, joka vastaa samalla tavalla pH: n muutokseen happo-emäsitrauksessa.
Siten graafinen jasolu vs. VNeitsyt, Voimme määrittää käännekohdan tai vastaavuuden, ja sen kanssa tiedämme analyytin pitoisuuden.
Potentiometrisiä asteita käytetään laajasti analyyttisissä ja fysikaalisissa kemiallisissa laboratorioissa. Jotkut analyytteistä, jotka voidaan määrittää tällä tekniikalla, ovat seuraavat: Usko2+, HCO3-, Ac2+, Mg2+, Cu2+, askorbiinihappo, Haluros, muun muassa.
Kaikkia asteita voidaan jossain määrin seurata potentiometrisen kautta sen sijaan, että turvautuisivat indikaattoreihin ja niiden viimeisiin pisteisiin.
Viitteet
- Päivä, r., & Underwood, a. (1986). Kvantitatiivinen analyyttinen kemia (Viides ed.-A. Pearson Prentice Hall.
- Skoog d.-Lla., Länsi D.M. (1986). Instrumentaalianalyysi. (Toinen Ed.-A. Amerikkalainen., Meksiko.
- DR. Doug Stewart. (2020). Määritelmä potentiometria. Toipunut: Chemicool.com
- Harvey David. (5. kesäkuuta 2019). Potntiometriset menetelmät. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Britannica Encyclopaedia. (2020). Elektrogravimetria. Toipunut: Britannica.com
- Wikipedia. (2020). Elektroanalyyttiset menetelmät. Haettu: vuonna.Wikipedia.org
- « Calomel -elektrodin toiminta, ominaisuudet, käyttää
- Stimuloivat lääkkeiden tyypit ja niiden ominaisuudet »

