Calomel -elektrodin toiminta, ominaisuudet, käyttää

- 1084
- 294
- Dr. Travis Reichert
Hän Calomel -elektrodi o Calomelanes on toissijainen elektrodi, joka mahdollistaa puolivälien potentiaalien määrittämisen elohopean ja elohopeakloridin (I), HG: n välisen reaktion ansiosta, Hg tapahtuu2Cl2, Aikaisemmin tunnettu nimellä Calomel. Molemmat reagenssit, Hg ja Hg2Cl2, He voittavat tai menettävät elektroneja riippuen siitä väliaineesta, johon elektrodi on upotettu.
Normaalisti lyhennettynä EC: nä, tämä elektrodi korvaa monissa mittauksissa tavanomaiseen vetyelektrodiin (SHE), koska sen rakentaminen on helpompaa ja vähemmän riskialtista manipuloida (huolimatta elohopeasta). Sen sisällä on KCL -liuos elektrolyyttisenä väliaineena elektronien virtaukselle.
 Calomel -elektrodi täydessä mittauksessa. Lähde: Chandrajit Karmakar, CC BY-SA 4.0, Wikimedia Commons
Calomel -elektrodi täydessä mittauksessa. Lähde: Chandrajit Karmakar, CC BY-SA 4.0, Wikimedia Commons Calomel -elektrodilla voi olla erilaisia variantteja sen koosta tai tärkeämpää riippuen KCL -pitoisuudesta. Kun KCL -liuos on tyydyttynyt, puhumme Saturado Calomelin (ESC) elektroista. ESC on helpompi valmistaa kuin EC, mutta herkempi lämpötilan muutoksille.
Tämän elektrodin käyttö on sallittu määrittää puolivälien potentiaalit lukemattomille redox -reaktioille. Se on myös toistuva laite potentiometrisissä määrityksissä, joilla pyritään tuntemaan analyytin määrän solusta riippuen ja mitattuna potentiaalista.
[TOC]
Toiminta
Joten Calomelin elektrodi toimii, HG-HG-pari2Cl2 Sinun on reagoitava, voitko tai menetät elektronit.
Katodinen
Kun elektronien vähentäminen tai vahvistus tapahtuu Calomel -elektrodin sisällä, meillä on seuraavat reaktiot:
Hg2Cl2 → Hg22+ + 2CL- (Ionisaatio)
Hg22+ + 2e- → 2HG (pelkistys)
Hg2Cl2 + 2e- → 2HG +2Cl- (Nettoreaktio)
Voi palvella sinua: Exoterminen reaktioSiksi Hg2Cl2 Voita elektroneja, jotka vähenevät metallisiin elohopeaan.
Elektrodin potentiaalinen E -sovellus, kun pelkistys tapahtuu, annetaan yhtälöllä:
E = Eº - 0.0591 loki [Cl--
Missä havaitaan, että se riippuu yksinomaan Cl -ionien pitoisuudesta-, on tämän mitatun elektrodin vakiovähennyspotentiaali tavanomaisen vetyelektrodin edessä.
Anodinen
Elektrodissa voi esiintyä myös hapettumisprosessia:
2HG → HG22+ + 2e- (Hapetus)
Hg22+ + 2CL- → Hg2Cl2 (Sademäärä)
2HG +2CL- → Hg2Cl2 + 2e- (Nettoreaktio)
Toisin sanoen elohopea hapettaa tuottamaan enemmän Hg: tä2Cl2.
Mahdollinen E tässä tapauksessa annetaan:
E = eº + 0.0591 loki [Cl--
Ja taas, ja se riippuu [Cl--.
Yleinen reaktio
Calomelin elektrodin yleinen reaktio on:
Hg2Cl2(s) + 2e- ⇌ 2HG (L) + 2Cl-
Tasapainon tunne riippuu väliaineesta, jossa elektrodi on yhteydessä. Cl- Määritä Hg: n liukoisuus2Cl2, jolla puolestaan on vaikutusta Hg: n muodostumiseen tai hapettumiseen.
Ja potentiaali määritetty määritellylle Cl -ionien pitoisuudelle- Se on yhtä suuri kuin:
JAkalomeli = Eruudukko - JAhärkä
E -ekalomeli Potentiaali, joka ilmoitetaan viitteenä tietyissä mahdollisissa taulukoissa.
Calomel -elektrodin ominaisuudet
Semi
Calomel Elektrodi -puoli -reuna voidaan edustaa seuraavasti:
PT | HG | Hg2Cl2Ja Cl- (XM)
Missä vain Cl -ionien pitoisuus on tärkeää-, ilmaistu molaarisuudessa tai normaalisuudessa. Elektrodin potentiaalinen E vaihtelee, jos se täytetään eri KCL -pitoisuuksien liuoksilla.
Esimerkiksi EC, jolla on KCL 0.1 m on a ja yhtä suuri kuin 0.3356 V 25 ° C: ssa; Kun taas ESC: llä, kyllästetyllä KCL: llä, on yksi ja yhtä suuri kuin 0.2444 V samassa lämpötilassa.
Voi palvella sinua: isopentano: rakenne, ominaisuudet, käyttötarkoitukset, hankkiminenSiksi KCL.
Kaupallisesti saavutetaan kolme tyyppiä kalomelielektrodeja: tyydyttyneitä (ESC), yhdeksästoista (0.1 n tai 0.1 m kcl) ja normaali (1 n tai 1 m Kcl). Calomel 1 M KCl: n elektrodi olisi esitetty seuraavasti:
PT | HG | Hg2Cl2Ja Cl- (1 m)
Puolueet
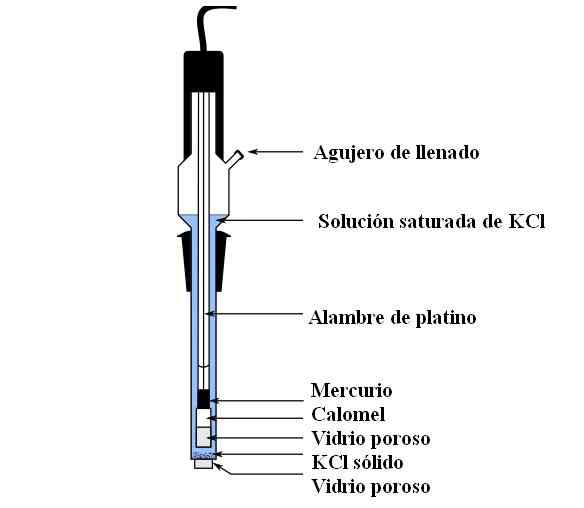 Calomel -elektrodin osat. Lähde: Bachi-Bouzou, CC0, Wikimedia Commons
Calomel -elektrodin osat. Lähde: Bachi-Bouzou, CC0, Wikimedia Commons Yläkuvassa näytämme tavallisen kalomelielektrodin pääosat. Se on valmistettu lasista ja koostuu kahdesta astiasta: ulkoisesta, joka asetetaan sähkökemialliseen kosketukseen mittausväliaineen kanssa ja sisältää KCL -liuoksen; Ja sisäinen, jossa HG-HG-seos lepää2Cl2.
Sisäisesti Calomel -elektrodi sisältää nestemäistä elohopeaa, jolle HG -tahna on kiinnittynyt2Cl2 kostutettu elohopealla. Tämä on elektrodin aktiivisin vaihe. Huokoista lasia käytetään sallimaan vain Cl -ionien pääsy tai poistuminen-, Mutta ei HG: n kiteitä2Cl2 tai elohopea pudottaa.
Platinumkaapeli, jossa elektronit virtaavat, upotetaan elohopeaan, ja vastaa elektrodin kytkemisestä volttimittariin ja kyseiseen ulkoiseen piiriin.
Täyttämisaukon läpi KCL -liuos kaadetaan, joka sisältää suolan liuennettua purkamista. Samaan aikaan elektrodin pohjassa meillä on hyvin pieni aukko huokoisessa lasissa, joka joutuu suoraan kosketukseen mittausväliaineen kanssa. Huokoisen lasin tarkoituksena on sallia kosketus ilman elektrodin tai näytteen saastuttavien aineiden vaihtoa.
Se voi palvella sinua: syklohexen: rakenne, ominaisuudet, synteesi ja käyttöEdut
Calomel -elektrodi esittelee seuraavat edut tavanomaisen vetyelektrodin suhteen:
-Helppo rakentaa ja manipuloida
-Sen solupotentiaali pysyy vakiona, vaikka vesi haihtuu
-Et tarvitse suolaliuosta
ESC on helpoin rakentaa Calomel -elektrodeista, koska KCL riittää liukenemaan, kunnes niiden kiteet ovat muodostuneet. Sitten liuos on kyllästetty ja valmis leviämään elektrodin sisään.
Haitat
Calomelin elektrodi esittelee kuitenkin seuraavat haitat:
-Sisällyttämällä nestemäistä elohopeaa, sillä voi olla kielteisiä vaikutuksia ympäristöön
-Sitä ei voida käyttää kvantitatiivisiin analyyseihin näytteissä, joiden lämpötila on yli 60 ºC, koska HG2Cl2 alkaa hajottaa, aiheuttaen elektrodilukemat epäonnistumisen
ESC: llä on myös haitta, että se on erittäin herkkä lämpötilan muutoksille.
Hopeahopeaelektrodi on korvannut kalomelin monissa potentiometrisissä määrityksissä.
Sovellukset
Calomelin elektrodi on yksi monista elektrodeista, joita käytetään päivittäin potentiometrisissä määrityksissä, mikä mahdollistaa analyyttien tai kiinnostuksen kohteena olevien lajien puolikäyttöpotentiaalit.
Myös Calomel -elektrodia käytetään pH -mittauksissa ja syklisessä voltmetriassa.
Viitteet
- Päivä, r., & Underwood, a. (1986). Kvantitatiivinen analyyttinen kemia (Viides ed.-A. Pearson Prentice Hall.
- Wikipedia. (2020). Tyydyttynyt kalomelielektrodi. Haettu: vuonna.Wikipedia.org
- Yleinen, eni. (20. lokakuuta 2018). Elektrodikalomeli. Kroatian-Englandin kemian sanakirja ja sanasto. KTF-Split. 30. lokakuuta. 2020. Toipunut: Sanasto.Kausi.com
- Skoog d.-Lla., Länsi D.M. (1986). Instrumentaalianalyysi. (Toinen Ed.-A. Amerikkalainen., Meksiko.
- Kukkulat, G., Ives, D. T. (1950). Calomel -elektrodi. Luonto 165, 530 doi.org/10.1038/165530A0
- Jmgav. (9. joulukuuta 2012). Potentiometria (II): elektrodit. Haettu: Triplenlace.com
- « Sosiaalikriittiset paradigman ominaisuudet, menetelmät, edustajat
- Potentiometrian perusteet, yhtälöt, elektrodit »

