Saostaa

- 4899
- 537
- Juan Breitenberg V
Selitämme, mikä on sakka, saostumisreaktio, olemassa olevat tyypit ja annamme useita esimerkkejä
 Keltainen sakan muodostuminen sekoittaessasi liuosta saostuvaa ainetta
Keltainen sakan muodostuminen sekoittaessasi liuosta saostuvaa ainetta Mikä on sakka?
Eräs saostaa Se on kiinteä aine, joka muodostuu liuoksesta, joko liuenneen aineen kiteyttämisellä tai liukenemattoman aineen muodostumisella kemiallisen reaktion kautta.
Ensimmäinen tapaus tapahtuu, kun kiinteä aine, joka alun perin liuennettiin liuottimeen, kuten vesi, muuttuu vähemmän liukoiseksi. Tämä voi tapahtua, kun:
- Liuoksen lämpötila laskee.
- Lisäysaine lisätään.
- Lisätään toinen liuotin, johon kiinteä aine on vähemmän liukoinen.
Kun sen liukoisuus muuttuu pienemmäksi kuin sen pitoisuus, liuos muuttuu ylikyllästetyksi ja saostumisreaktio tapahtuu.
Toinen tapaus tapahtuu minkä tahansa kemiallisen reaktion jälkeen, joka tuottaa liuottimen liukenemattoman tai hyvin vähän liukoisen tuotteen. Kun tämä tuote alkaa muodostua, liuos on nopeasti kyllästetty ja kiinteä aine alkaa saostaa.
Kemiallinen saostumisreaktio
Saostumisreaktio on kemiallinen prosessi, joka johtaa sakan muodostumiseen. Reaktio voidaan kirjoittaa kahdella eri tavalla riippuen sakan muodostumisesta:
- Jos saostuminen tapahtuu, koska kiinteän aineen liukoisuus liuottimeen vähensi (esimerkiksi jäähdytys tai lisäämällä toinen liuotin), saostumisreaktio sisältää vain liuenneen aineen ja näyttäisi tältä:

Esimerkiksi, Jos natriumasetaatti liukenee (ch-3Tasku) kuumaan veteen ja sitten sallitaan jäähtyä, natriumasetaatti saostuu seuraavan yhtälön mukaan:

- Jos saostuminen tapahtuu, koska saostusaine lisättiin, saostumisreaktio sisältää sekä liuenneen että saostuvan aineen.
Esimerkiksi, Hopea -ionit (AG+) Ne voivat saostua hopea -nitraattiliuoksesta (Agno3) natriumkloridin tai NaCl -liuoksen lisääminen (saostava aine). Saostumisreaktio on tässä tapauksessa:
Se voi palvella sinua: nikkelikloridi (NICL2): rakenne, ominaisuudet, hankkiminen, käyttö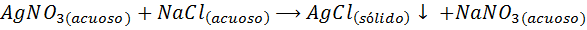
Sademekanismi
Saostumisreaktiosta riippumatta sakan muodostuminen tapahtuu aina kahdessa vaiheessa, joita kutsutaan ytimeksi ja kasvuksi:
-
Ydin
Saostumisreaktion alussa muodostuu pieniä saospartikkeleita, joita kutsutaan ytimiksi, joten tätä vaihetta kutsutaan ytimeksi.
-
Kasvu
Ytimen jälkeen uusia hiukkasia ei enää muodostua, mutta jo muodostuneet ytimet alkavat kasvaa, kunnes saostuminen pysähtyy.
Sakkatyypit
Sakkojen muodostetut nopeus vaikuttaa kiinteiden hiukkasten kokoon ja saman ominaisuuksiin. Hiukkasten koosta ja saostuvan yhdisteen luonteesta riippuen voidaan erottaa kolmen tyyppiset saostumat:
Kiteinen saostuminen
Se on yksinkertaisin saostuma tyyppi. Tässä tapauksessa sakka koostuu suurista kiinteistä hiukkasista, joiden halkaisija on suurempi kuin 0,1 mikrometriä.
 Kuparisulfaatin (ii) pentahydraatin kiteinen sakka
Kuparisulfaatin (ii) pentahydraatin kiteinen sakka Kiteiset saostumat muodostuvat, kun saostumisreaktio tapahtuu hitaasti. Tämä sallii muutaman kiinteän hiukkasen muodostumisen ytimen muodostumisen aikana, ja jokaisella näistä hiukkasista on tarpeeksi aikaa kasvaa ja muodostaa suuria ja raskaita kiteitä, jotka putoavat liuoksen pohjaan.
Nämä hiukkaset ovat melkein aina kiteisiä kiinteitä aineita, joilla.
Tapaus
Ne saostetaan paljon pienemmille hiukkasille, halkaisijaltaan 0,01 - 0,1 mikrometriä. Tämän tyyppinen sakka muodostuu, kun saostumisreaktio tapahtuu erittäin nopeasti, mikä tuottaa monia hiukkasia ytimen aikana, joilla ei ole aikaa kasvaa.
Niiden koon vuoksi nämä hiukkaset ovat erittäin kevyitä ja suspendoituna liuokseen muodostaen stabiilin kolloidin. Tästä syystä he eivät astu ratkaisun pohjaan ja se näyttää pilviseltä läpinäkyvän sijasta.
Voi palvella sinua: dihydroksiasetoni: rakenne, ominaisuudet, hankkiminen, käyttö Kolme eri väriä. Kolme ratkaisua ovat hämärät saostumien muodostumisen jälkeen
Kolme eri väriä. Kolme ratkaisua ovat hämärät saostumien muodostumisen jälkeen Tämän lisäksi hiukkaset ovat niin pieniä, että ne onnistuvat ylittämään suurimman osan suodattimista, joita käytetään saostumien erottamiseen liuoksista.
Jellyry Hacords
Kun hiukkaset ovat jopa pienempiä kuin kovettuneiden saostumien, ts. Halkaisijoiden ollessa alle 0,01 mikrometriä, saostumia kutsutaan hyytelöksi. Syynä on se, että kiinteä kiinteä on kuin gelatiini tai hillo.
Näitä saostumia pidetään myös kolloideina. Itse asiassa gelatiini on tyypillinen esimerkki kolloidista, ja nämä sateet ottavat nimensä samasta.
Tyypillisiä esimerkkejä hyytelöistä ovat joidenkin metallien hydratoituja oksideja. Nämä oksidit absorboivat suuren määrän vettä niiden pinnalle, mikä estää sitä muodostamasta suurempia hiukkasia, jotka kiteytyvät.
Sadeesimerkit
Natriumasetaatti (CH3Tasku)
Kuten edellä mainittiin, natriumasetaatti voidaan saostaa kuumasta kylläisestä liuoksesta, jonka annetaan jäähtyä. Jos sen sallitaan jäähtyä hitaasti, muodostetaan kiteinen sakka, jossa havaitaan pitkiä valkoisia neulakiteitä.
Kadmiumsulfidi (II) (CDS)
Kadmiumsulfidi on erittäin liukenematon suola, joka sekoitetaan välittömästi kadmiumionien (II) liuokseen toisen kanssa, joka sisältää sulfidi -ioneja.
Kuparisulfaatti (ii) pentahydraatti (cuo4.5H2JOMPIKUMPI)
Kun se liukenee veteen, kuparisulfaatti (II) muodostaa hydratoituja ioneja intensiivistä sinistä. Jos vesi haihtuu hitaasti, saosta kauniit siniset kiteet Cuso4.5H2JOMPIKUMPI. Nämä kiteet näyttävät arvokkailta kiviltä.
Hopeabromidi (AGBR)
Tämä on esimerkki yhdisteestä, joka saostuu erittäin nopeasti muodostaen sakan erittäin ohuilla hiukkasilla, joita on vaikea suodattaa.
Voi palvella sinua: vastaava painoAlumiini hydratoitu oksidi (III) (2JOMPIKUMPI3.Nh2JOMPIKUMPI)
Tämä on klassinen esimerkki gelatiinin sakan muodostumisesta. Se muodostuu, kun alumiininitraattiliuos (ei (ei3-A3-A.
Mangaanisulfidi (II) (MNS)
Monet sulfidit ovat liukenemattomia veteen ja mangaanisulfidi ei ole poikkeus. Tämä saostuu erittäin hienon pölyn muodossa.
Hopeakloridi (AGCL)
Hopea -ionit (i) muodostavat hyvin vähän liukoisia suoloja kaikilla halogeeneilla. Hopeakloridin tapaus on klassinen esimerkki saostetusta muodostumisesta laboratoriossa.
Kalsiumkarbonaatti (Caco3-A
Kalsium on yksi veden kovuudesta vastuussa olevista ioneista. Kun kalsiumia sisältävä vesi lämmitetään, se reagoi muodostaen kalsiumkarbonaatin, joka saostuu valkoisen kerroksen muodossa, nimeltään tartari, joka jopa pystyy estämään putket.
Rauta hydratoitu oksidi (III) (usko2JOMPIKUMPI3.Nh2JOMPIKUMPI)
Tämä on toinen esimerkki gelatiinista saostumasta, joka muodostuu rauta -ioneista (III) reaktiolla natrium- tai kaliumhydroksidilla.
Magnesiumhydroksidi (MG (OH)2-A
Magnesium on toinen kationia, joka vastaa veden kovuudesta, koska se voi saostaa magnesiumhydroksidin muodossa putkissa ja muissa vesilämmitysjärjestelmissä.
Viitteet
- Bancoft, W. D -d. (1918). Kolloidikemian ääriviivat.-III. Franklin -instituutin lehti, 185(3), 373-387. https: // doi.org/10.1016/S0016-0032 (18) 90710-6
- Civan, f. (2007). Kristallin kasvu ja mittakaavan muodostuminen huokoisessa väliaineessa. Säiliön muodostumisvaurio, 235-255. https: // doi.org/10.1016/B978-075067738-7/50010-5
- Skoog, d. -Lla., Länsi, D. M., Holler, f. J -., & Crouch, S. R -. (2013). Analyyttisen kemian perusteet. New York City, New York: Cengage Learning.
- Wikipedian avustajat. (2021, 10. tammikuuta). Saostuminen (kemia). Haettu jstk.Wikipedia.org

