Proliiniominaisuudet, rakenne, toiminnot, ruoka
- 3516
- 397
- Louis Moen
Se Proline (Pro, p) kuuluu 22 aminohappoa, jotka on luokiteltu emäksiseksi. Se on ei -välttämätön aminohappo, koska ihminen ja muut nisäkkäiden eläimet voivat syntetisoida sen.
Vuonna 1900 saksalainen tiedemies Richard Willstatter oli ensimmäinen, joka otti ja tarkkaili proliinia. Emili Fischer kuitenkin vuonna 1901 keksi termin "proliini", joka perustui aminohapon pyrrolidiinirenkaan; Tämä tutkija onnistui myös selittämään yksityiskohtaisesti proliinin synteesin maidon kaseiinista.
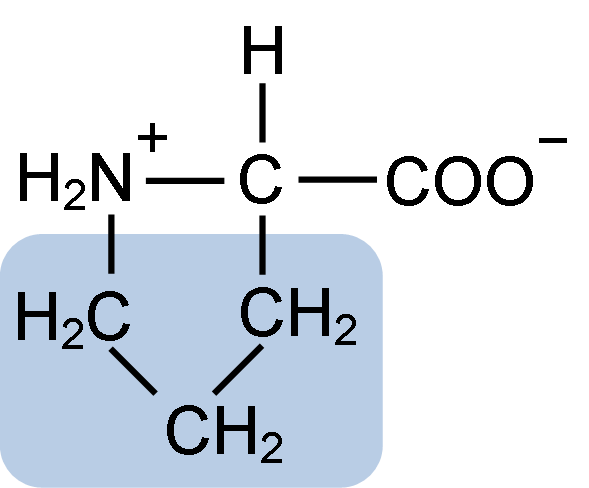
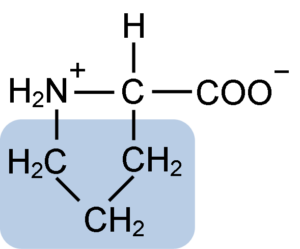 Proliiniaminohapon kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Proliiniaminohapon kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Proteiineissa, kuten kaseiini, proliinilla on välttämätön toiminta "käännöksissä" ja rakenteellisissa taitoksissa. Tässä proteiinissa proliini jakautuu homogeenisesti koko rakenteen ajan ja yhteydet β -kaseiiniin ja aS1 -proteiiniin; Lisäksi se estää viallisia rakennesilmukoita tai taitettua.
Proteiinien muodostavien aminohappojen tarkan sekvenssin määrittämisessä käytetyissä biokemiallisissa analyyseissä proliini on yksi vaikeimmista havaitsemista aminohapoista, koska proliinin sekundaarisella aminoryhmällä on erilainen käyttäytyminen eikä sitä voida helposti havaita.
Scurvy on ehkä tunnetuin proliiniin liittyvä sairaus. Se liittyy C -vitamiinin saannin puutteeseen, joka vaikuttaa suoraan proliinin hydroksylaatioon kollageenikuituissa, mikä aiheuttaa systeemistä heikentymistä kollageenikuitujen epävakauden vuoksi, jotka ovat koko kehossa.
[TOC]
Ominaisuudet
Hiilen sitova sekundaarinen amino -ryhmä α tekee proliiniluokitustehtävästä jonkin verran vaikeaa. Joissakin teksteissä tämä luokitellaan kuitenkin haarautuneiden aminohappojen viereen tai alifaattisten sivuketjujen kanssa, koska proliinin sivuketju tai R r on hydrofobinen tai alifaattinen.
Yksi proliinin tärkeimmistä ominaisuuksista on, että vety sillat eivät missään tapauksessa voi muodostaa, mikä tekee ihanteellisesta rakentaa monimutkaisia ja monimutkaisia käännöksiä proteiinien tertiäärisissä rakenteissa.
Aivan kuten kaikissa aminohapoissa on kaksi isomuotoa, jotka riippuvat keskushiiliatomista, proliini löytyy luonnosta, kuten L-proliini tai D-PROLOL. Muoto L-prolina on kuitenkin luonteeltaan runsain ja se on osa proteiinirakenteita.
Proteiineissa, joissa se sijaitsee.
Rakenne
Proliinilla on erityinen rakenne emäksisten aminohappojen välillä, koska se esittelee aminoryhmää (NH2) sekundaarista eikä primaarista aminohuryhmää, joka on ominainen kaikille aminohapoille.
Ryhmä R tai proliinin sivuketju on pyrrolidiini tai tetrahydropirrolirengas. Tämä ryhmä muodostuu viiden hiiliatomin heterosyklisestä amiinista (ei kaksoissidoksista), joissa kukin näistä on kyllästetty vetyatomilla.
Proliinilla on erityispiirte, että "keskus" hiiliatomi sisältyy heterosykliseen pyrolidiinirenkaaseen, joten ainoat "vapaa" tai "erinomaiset" atomit ovat karboksyyliryhmä (COOH) ja heterosyklisen renkaan vetyatomi (h) (h) (H) (h) (H) heterosyklinen rengas (h) (heterosyklinen rengas) (h) (heterosyklinen rengas) heterosyklisen renkaan (H) heterosyklisen renkaan (heterosyklinen rengas). aminohappo.
Voi palvella sinua: superoksididysmutaasi: ominaisuudet, rakenne, toiminnotProliinin molekyylinen kaava on C5H9NO2 ja sen IUPAC-nimi on pirrolidiini-2-karboksyylihappo. Sen likimääräinen molekyylipaino on 115,13 g/mol ja sen esiintymistiheys proteiineissa on noin 7%.
Funktiot
Kollageeni- ja tropokollageenikuidut ovat useimmissa selkärankaisten eläimissä kaikkein runsaimpia proteiineja. Nämä muodostavat ihon, jänteet, luusatriisin ja monet muut kudokset.
Kollageenikuidut koostuvat monista kolminkertaisista polypeptidi-liipaisimista, jotka puolestaan koostuvat monista proliini- ja glysiinitähteistä glysiini-praktoliini-proliini/hydroksiprololiinisekvenssissä (jälkimmäinen on proliinin modifioitu johdannainen).
Alkuperäisessä muodossaan proliini on osa prokollageenia, tämä on kollageeenin polypeptidien edeltäjä ja joidenkin muiden sidekudoksen proteiinien proteiinit. Entsyymi proliinihydroksylaasi.
Mikä on proliinin päätoiminto kollageenikuituissa?
Hydroksiproliini antaa kollageeniresistenssiominaisuudet, koska tällä aminohappojohdannaisella on kyky muodostaa suuri määrä vety silloja kolminkertaisten potkurin ketjujen välillä, jotka muodostavat proteiinin.
Entsyymit, jotka katalysoivat proliinijätteiden hydroksylaatiota, vaativat C -vitamiinin (askorbiinihappoa) esiintymistä, ja kuten edellä mainittiin, skurjus johtuu kollageenikuitujen heikentymisestä, joka johtuu proliinijätteen hydroksyloinnista, mikä aiheuttaa vähenemistä vety sillat, jotka ylläpitävät kollageenikuituja.
Muut toiminnot
Proliini on välttämätöntä laskosten ja proteiinien käännösten muodostumisessa.
Sen suljettu rakenne vaikeuttaa tämän aminohappoa "sisäisten proteiinien" mukauttamisen suhteen, koska se ei voi muodostaa vety siltoja "olla vuorovaikutuksessa" muiden lähellä olevien jätteiden kanssa, se indusoi "käännösten" tai "kääntymisen" muodostumisen proteiinien rakenteeseen pitkin missä se sijaitsee.
Kaikilla lyhyellä elinaikalla varustetuilla proteiineilla on ainakin alue, jossa on runsaasti toistuvia proliinia, glutamaattia, seriiniä ja treonine. Nämä alueet menevät 12: sta 60: een ja niitä kutsutaan tuholaisjärjestykseksi.
Tuholaissekvenssiä sisältävät proteiinit merkitään ubiquitinaation avulla seuraavaa hajoamista varten proteosomeissa.
Biosynteesi
Monet aminohapot voidaan syntetisoida glykolyysivälin, pentoosifosfaatin tai sitruunahapposyklin (Krebs -sykli). Proliini ja arginiini muodostetaan lyhyillä glutamaattireiteillä.
Kaikkien elävien organismien käytännöllisesti katsoen yleinen biosynteettinen reitti alkaa L-glutamaatin muuntamisella γ-L-glutamili-5-fosfaatissa glutamaatin-5-quinous-entsyymin (bakteereissa) tai γ-glutamilin vaikutuksen ansiosta (bakteereissa). Whinas (ihmisillä).
Tämä reaktio merkitsee ATP -riippuvaista fosforylaatiota, joten päätuotteen lisäksi syntyy ADP -molekyyli.
Reaktio, jota katalysoi glutamaatin 5-SMI-Limid-dehydrogenaasi (bakteereissa) tai y-glutamiilireduktaasifosfaatilla (ihmisillä) muuntaa y-L-glutamili-5-fosfaatin L-glutamaattiksi-5-SMI-LIDID: n läsnäoloksi. Co -tekijä Nadph.
Voi palvella sinua: puoliksi Stuart: perusta, valmistelu ja käyttötarkoituksetL-glutamato-5-semialdehydi on palautuva ja spontaanisti dehydratoitu (S) -1-1-pyrroliin), jonka reaktiossa on myös tarpeen NADPH: n tai NADH: n molekyyli.
Heikkeneminen
Proliini, arginiini, glutamiini ja histidiini hajotetaan jatkuvasti a-zetoglutaraatiksi pääsemään sitruunahappo- tai Krebs-syklille. Proliinin erityistapauksessa proliinioksidaasientsyymi hapettaa tämän ensin pirroliini-5-karboksylaattiin.
Ensimmäisessä vaiheessa, jossa proliinin hapettuminen pirroliini-5-karboksylaattiin tapahtuu, e-fad hyväksyy irrotetut protonit, jotka vähenevät e-fadh2: een; Tämä vaihe on yksinoikeudella aminohappon proliinille.
Spontaanista reaktiosta johtuen pirroliini-5-karboksylaatti transformoituu y-semialdehydi-glutamaatiksi, joka sitten toimii substraattina entsyymi-glutamaatin y-Semi-Limidic-dehydrogenaasille. Tässä vaiheessa kaksi protonia ilmenee, NAD hyväksyy toisen niistä, jotka pelkistetään NADH: ksi, ja toinen on ilmainen H: n muodossa+.
Arginiini, kuten proliini, muuttuu y-semialdehydi-glutamaatiksi, mutta vaihtoehtoisen metabolisen reitin kautta, johon kaksi eri entsyymiä osallistuu.
Γ-Semialdehydi-glutamaatin entsyymidehydrogenaasi muuttaa glutamaatin y-semialdehydin L-glutamaatiksi. Myöhemmin tämä L-glutamaatti hapettuu jälleen entsyymi glutamaattidehydrogenaasilla, joka lopulta muodostaa a-zetoglutaraatin, joka sisällytetään sitruunahapposykliin.
Glutamaatin hapettumiskohdassa protoni (H+) vapautuu ja amino -ryhmä (NH3+). Protoni vähentää NADP+ -ryhmää ja NADPH -molekyyli on peräisin.
Huolimatta monista yhtäläisyyksistä, joita esiintyy proliinin ja arginiinin hajoamisen ja biosynteesireiteiden välillä, nämä aminohapot syntetisoidaan ja hajoavat täysin vastakkaisilla reiteillä, jotka käyttävät erilaisia entsyymejä, erilaisia kofaktoreita ja jotka tapahtuvat erilaisia solunsisäisiä osastoja.
Ruoat, joissa on rikas Valina
Yleensä kaikilla runsaasti proteiinipitoisuuksilla on suuria määriä proliinia. Näiden joukossa on liha, maito, munat ja muut. Kuitenkin, kun kehomme on optimaalisessa terveyden ja ravitsemuksen tilassa, se kykenee syntetisoimaan proliinia endogeenisiä.
Proliinia löytyy myös monista palkokasveista ja pähkinöistä sekä esimerkiksi kokonaisista jyvistä, kuten kaurajauho. Muita proliiniruokia ovat mm. Vehnän leseet, pähkinät, mantelit, herneet, pavut.
Jotkut naturistikaupat formuloivat yleensä aminohappojen L-Lisinan ja L-prololinan yhdistettyjen yhdistettyjen yhdistettyjen ihmisten kanssa, joilla on nivelongelmia tai viivästyttämään kudosten ikääntymistä.
Ei kuitenkaan ole osoitettu varmasti, että näiden aminohappojen ruokavaliolisäaineiden nauttimisella on merkittävä vaikutus vanhuuteen tai muihin ikätilanteisiin.
Saannisi edut
Proliinia sisältäviä ruokavalioita on yleensä määrätty ihmisille, joilla on niveltauteja, kuten niveltulehdus, nyrjähdykset, nivelsidetilojen rikkoutuminen, dislokaatiot, jännetulehdus ja muut, ja tämä johtuu niiden suhteista kehon sidekudoksissa olevien kollageenikuitujen synteesiin.
Voi palvella sinua: agar m.R -.S: Mikä on, perusta, valmistelu, käyttääMonet esteettisessä teollisuudessa käytetyistä farmakologisista voiteista ja tabletteista ovat rikastettuja L-proliinilla, koska jotkut tutkimukset ovat osoittaneet, että tämä aminohappo voi jotenkin lisätä kollageenisynteesiä ja parantaa siksi ihon tekstuuria, nopeuttaa haavojen paranemista, haavaumat ja palovamma.
Elintarviketeollisuudessa on proteiineja, joilla on ”bioaktiivisia peptidejä”, jotka liikuntavat ravitsemusominaisuuksiensa ulkopuolella. Näillä peptideillä on yleensä kaksi tai yhdeksän aminohappojätettä, joista proliinia, arginiinia ja lysiiniä on runsaasti.
Näillä bioaktiivisilla peptideillä voi olla verenpainelääketoiminta tietyllä opioidivaikutuksella; Ne voivat toimia immunomodulaattoreina stimuloimalla immuunivastetta joitain patogeenejä vastaan ja voivat jopa aiheuttaa verisuonten lisääntymistä, mikä parantaa niitä, jotka kuluttavat niitä.
Puutoshäiriöt
Gluteeni on proteiini, joka on läsnä vehnän jyvissä, jotka aiheuttavat suoliston tulehduksia. Ihmiset, jotka kärsivät "gluteenia intoleranssista".
Jotkut sairaudet liittyvät tärkeiden proteiinien huonon taittumisen kanssa ja on hyvin yleistä, että nämä viat liittyvät isomerointiin IVY-trans Amida -yhteyksiä proliinijätteessä, koska toisin kuin muut peptidilinkit, joissa isomeeri trans Se on hyvin suosittu, proliinissa se on heikommassa asemassa.
Proliinijätteessä on havaittu, että isomeerin muodostumiseen on merkittävä taipumus IVY ensin kuin isomeeri trans Viereisissä amideissa proline jätteiden proliinia varten, mikä voi tuottaa "virheellisen" proteiinien konformaation.
Aineenvaihduntahäiriöt
Kuten muutkin välttämättömät ja ei -välttämättömät aminohapot, proliiniin liittyvät tärkeimmät patologiset häiriöt on yleensä tehtävä tämän aminohapon assimilaatioreittien vikojen kanssa.
Esimerkiksi hyperprolinemia on tyypillinen puutos tapaus yhdellä entsyymeistä, jotka osallistuvat proliinin hajoamisreitille, erityisesti 1-pyroliini-5-karboksylaattidehydrogenaasiin, joka johtaa sen substraatin kertymiseen, joka lopulta oli inaktiivinen reitti reittiä.
Tätä patologiaa diagnosoidaan yleensä korkean proliinipitoisuuden avulla veriplasmassa ja 1-pyrrololiini-5-karboksylaattimetaboliitin läsnäololla sairastuneiden potilaiden virtsassa.
Tämän taudin pääoireet koostuvat neurologisista häiriöistä, munuaissairauksista ja kuulokapasiteetin tai kuurojen menetyksistä. Muita vakavampia tapauksia ovat vakava henkinen viive ja merkittävät psykomotoriset vaikeudet.
Viitteet
- Abu-Baker, S. (2015). Katsaus biokemiaan: Käsitteet ja yhteydet
- Delauney, a. J -., & Verma, D. P. S. (1993). Proliinin biosynteesi ja osmoregulaatio kasveissa. Plant Journal, 4 (2), 215-223.
- Lista, b., Lerner, r. -Lla., & Barbas, c. F. (2000). Proliinikatalysoidut suorat epäsymmetriset aldolireaktiot. Journal of American Chemical Society, 122 (10), 2395-2396
- Nelson, D. Lens., Lehninger, a. Lens., & Cox, M. M. (2008). Lehninger -biokemian periaatteet. Macmillan.
- Plimmer, r. H. -Lla. (1912). Proteiinien kemiallinen perustuslaki (VOL. 1). Longmans, vihreä.
- Szabados, l., & Savouré,. (2010). Proliini: monitoiminen aminohappo. Kasvitieteen suuntaukset, 15 (2), 89-97.

