Elementtien ja niiden ominaisuuksien jaksolliset ominaisuudet

- 4215
- 501
- Sheldon Kuhn
Se Elementtien säännölliset ominaisuudet He ovat niitä, jotka määrittelevät fysikaalisen ja kemiallisen käyttäytymisensä atomisperspektiivistä ja joiden suuruudet atomilukujen lisäksi sallivat atomien luokituksen.
Kaikista ominaisuuksista nämä ovat karakterisoituja, kuten nimi viittaa, koska ne ovat määräajoin; Toisin sanoen, jos jaksollista taulukkoa tutkitaan, voidaan todistaa, että sen suuruudet noudattavat trendiä, joka vastaa ja toistaa elementtien tilaamalla jaksoina (riveissä) ja ryhmissä (sarakkeissa) (sarakkeet).
 Osan osittain jaksollisen taulukon elementtien luontainen jaksollisuus. Lähde: Gabriel Bolívar.
Osan osittain jaksollisen taulukon elementtien luontainen jaksollisuus. Lähde: Gabriel Bolívar. Esimerkiksi, jos matkustat jaksollisen ajanjakson ja omaisuuden vähenee kunkin elementin suuruudella, sama tapahtuu kaikilla ajanjaksoilla. Toisaalta, jos menee ryhmään tai sarakkeeseen, se lisää sen suuruutta, samaa voidaan odottaa muille ryhmille.
Ja siten niiden variaatiot toistetaan ja todistetaan yksinkertaisen suuntauksen, joka sopii elementtien tilaamiseen heidän atomilukujensa suhteen. Nämä ominaisuudet ovat suoraan vastuussa elementtien metallisesta tai ei -metallisesta luonteesta sekä niiden reaktiivisuudesta, mikä on auttanut niitä luokittelemaan enemmän syvyyttä.
Jos elementtien identiteettiä ei ollut hetkeksi tuntematon ja niitä pidettiin omituisina "palloina", jaksollinen taulukko voitaisiin rakentaa uudelleen (paljon työtä) hyödyntämällä näitä ominaisuuksia.
Tällä tavoin oletetut pallot hankkivat värejä, joiden avulla he voivat erottaa ne toisistaan ryhmissä (ylivoimainen kuva). Tietäen niiden elektroniset ominaisuudet, he voisivat organisoida ajanjaksoina, ja ryhmät pettäisivät ne, joilla on sama määrä valenssielektroneja.
Oppiminen ja perustelut jaksolliset ominaisuudet ovat yhtä mieltä siitä, miksi elementit reagoivat tavalla tai toisella; Se on tietää, miksi metallielementit ovat tietyillä taulukon alueilla, ja ei -metalliset elementit toisessa.
[TOC]
Mitkä ovat jaksolliset ominaisuudet ja niiden ominaisuudet
-Atomiradio
Kuvan tarkkailun palloa ensin, joka voidaan huomata, on, että kaikki eivät ole samankokoisia. Jotkut ovat tilaa vieviä kuin toiset. Jos havaitaan yksityiskohtaisemmin, havaitaan, että nämä koot vaihtelevat kuviota: ajanjaksona se pienenee vasemmalta oikealle ja ryhmässä kasvaa ylhäältä alas.
Yllä oleva voidaan sanoa myös tällä tavalla: atomisäde vähenee oikean ryhmiä tai sarakkeita kohti ja lisääntyy alemmilla ajanjaksoilla tai riveillä. Siten atomisäde on ensimmäinen jaksollinen ominaisuus, koska sen variaatiot seuraavat elementtien kuviota.
Ydinkuorma vs. elektronit
Mikä on tämä malli? Atomi -elektronit vievät ajanjaksona saman energiatason, joka liittyy etäisyyteen, joka erottaa ne ytimestä. Kun siirrymme ryhmästä toiseen (mikä on sama kuin ajanjakso oikealle), ydin lisää sekä elektronit että protonit samaan energiatasoon.
Voi palvella sinua: hiiliSiksi elektronit eivät voi miehittää etäisyyksiä kauempana ytimestä, mikä lisää sen positiivista kuormaa, koska siinä on enemmän protoneja. Tämän seurauksena elektronit kokevat suuremman vetovoiman ytimeen, houkuttelemalla niitä yhä enemmän protonien määrän kasvaessa.
Siksi jaksollisen taulukon oikeassa päässä olevissa elementeissä (keltaiset ja turkoosi pylväät) on pienempi atomiradioita.
Toisaalta, kun "hyppää" yhdestä jaksosta toiseen (mikä on sama sanottava, että ryhmä on syntynyt), uudet mahdollistavat energiatasot antavat elektronien miehittää kaukaisempia tiloja ytimessä. Lisäksi ydin (enemmän protoneja) houkuttelee heitä vähemmän voimalla; Ja siis atomiradiot kasvavat.
Ionirapio
Ioniset radiot noudattavat mallia, joka on samanlainen kuin atomiradioiden kuvio; Ne eivät kuitenkaan riipu niin paljon ytimestä, mutta kuinka monella elektronilla tai vähemmän on atomi sen neutraaliin tilaan nähden.
Kationit (na+, Ac2+, Siihen3+, Olla2+, Usko3+) osoittavat positiivista kuormaa, koska he ovat menettäneet yhden tai useamman elektronin, ja siksi ydin houkuttelee heitä suuremmalla voimalla, koska niiden välillä on vähemmän torjuvia. Tulos: kationit ovat pienempiä kuin atomit, joista ne johdetaan.
Ja anioneille (tai2-, F-, S2-, Yllyttää-) Päinvastoin, heillä on negatiivinen kuorma, koska siinä on yksi tai useampi ylimääräinen elektronia, mikä lisää sen torjuntaa toistensa kanssa ytimen käyttämän vetovoiman yläpuolelle. Tulos: anionit ovat suurempia kuin atomit, joista ne johdetaan (alempi kuva).
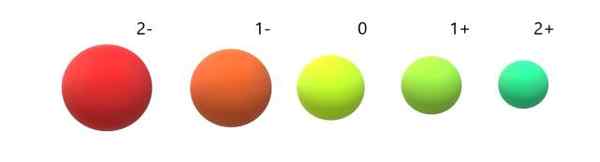 Ionisten radioiden variaatio neutraalin atomin suhteen. Lähde: Gabriel Bolívar.
Ionisten radioiden variaatio neutraalin atomin suhteen. Lähde: Gabriel Bolívar. Voidaan nähdä, että anion 2- on kaikkein laajin ja kation 2+ pienin. Radiot lisääntyvät, kun atomi on negatiivisesti varautunut, ja se sopimukset, kun se on positiivisesti veloitettu.
-Elektronegatiivisuus
Kun elementeillä on pieniä atomiradioita, niiden elektronit eivät vain houkuttele suuresti, vaan myös naapuriatomien elektroneja, kun se muodostaa kemiallisen sidoksen. Tämä taipumus houkutella muiden atomien elektroneja yhdisteessä on ns.
Se, että atomi on pieni, ei tarkoita, että se on elektronegatiivisempi. Jos näin on, helium- ja vetyelementit olisivat elektronegatiivisimmat atomit. Helium siihen, mihin tiede on osoittanut, ei muodosta minkäänlaista kovalenttista linkkiä; Ja vety, tuskin on yksi protoni ytimessä.
Voi palvella sinua: kuparisulfidi: rakenne, ominaisuudet, käytötKun atomiradiot ovat suuria, ytimillä ei ole tarpeeksi voimaa houkutella muiden atomien elektroneja; Siksi kaikkein elektronegatiivisimmat elementit ovat ne, joilla on pieni atomisäde ja suurempi määrä protoneja.
Jälleen ne, jotka täyttävät nämä ominaisuudet täydellisesti, ovat jaksollisen taulukon P -lohkon ei -metallisia elementtejä; Nämä ovat ryhmään 16 tai happea (O, S, SE, TE, PO) ja ryhmän 17 tai fluorin (F, Cl, BR, I, AT).
Trendi
Kaikkien sanottujen elektronegatiivisimpien elementtien mukaan etenkin jaksollisen taulukon oikeassa yläkulmassa; Fluoridilla elementtinä, joka johtaa elektronegatiivisimmasta luettelosta.
Koska? Turvautumatta elektronegatiivisuusasteikkoihin (Pauling, Mulliken jne.), fluori, vaikka se on suurempi kuin neon (ajanjaksonsa jalo kaasu), ensimmäinen voi muodostaa yhteyksiä, kun taas toinen ei. Lisäksi pienellä koolla sen ytimessä on monia protoneja, ja missä fluori on, on dipolimomentti.
-Metallinen merkki
Jos elementillä on atomisäde verrattuna saman ajanjakson säteisiin, ja se on myös vähän elektronegatiivista, se on sitten metalli ja sillä on korkea metallinen merkki.
Jos palaamme pääkuvaan, punertavan ja vihertävän pallot, samoin kuin harmaa, vastaavat metallielementtejä. Metalleilla on ainutlaatuiset ominaisuudet, ja täältä aineen fysikaaliset ja makroskooppiset ominaisuudet alkavat toisiinsa liittyä toisiinsa.
Elementeille, joilla on korkea metallinen luonne, on ominaista niiden suhteellisen suuret atomit, helppo menettää elektroneja.
Seurauksena on, että ne hapettelevat tai menettävät elektronit helposti muodostaen kationien, m+; Tämä ei tarkoita, että kaikki kationit ovat metallisia.
Trendi
Tässä vaiheessa voit ennustaa, kuinka jaksollisen taulukon metallinen merkki vaihtelee. Jos tiedetään, että metalleilla on suuret metalliradion ja että elektronegatiivit ovat myös vähän, raskaimpien elementtien (alemmat ajanjaksot) olisi odotettavissa, olettavinta; ja kevyemmät elementit (ylemmät jaksot), vähiten metallia.
Samoin metallinen merkki vähentää sitä enemmän elektronegatiivista elementtiä. Tämä tarkoittaa, että jaksojen ja ryhmien kiertäminen jaksollisen taulukon oikealla puolella, korkeamman ajanjakson aikana, vastaa vähiten metallisia elementtejä.
Siksi metallinen luonne kasvaa laskeutumalla ryhmään ja laskee oikeaan oikeaan samaan ajanjaksona. Metallielementeistä, joita meillä on: na (natrium), li (litium), mg (magnesium), ba (barium), ag (hopea), au (kulta), po (polonio), pb (lyijy), cd (cd (kadmium ), (Alumiini) jne.
Voi palvella sinua: kiehumiskohta: Konsepti, laskenta ja esimerkit-Ionisaatioenergia
Jos atomilla on suuri atomisäde, odotetaan, että sen ydin ei pidä elektroneja huomattavaan lujuuteen uloimpien kerroksissa. Näin ollen niiden poistaminen atomista kaasufaasissa (yksilöity) ei vaadi paljon energiaa; Tämä on ionisaatioenergia, EI, välttämätön elektronin poistamiseksi.
Myös yhtä suuri sanotaan, että energia on toimitettava atomin tai kaasu -ionin ytimen vetovoiman voittamiseksi sen uloimmalla elektronilla. Mitä pienempi atomi ja elektronegatiivisempi, sitä alempi IT on; Tämä on taipumuksesi.
Seuraava yhtälö kuvaa esimerkkiä:
Na (g) => na+(g) + e-
Tämän saavuttamiseksi välttämätön ei ole niin suuri toiseen ionisaatioon verrattuna:
Naa+(g) => na2+(g) + e-
Koska NA: ssa+ Positiiviset varaukset ovat vallitsevia ja ioni on pienempi kuin neutraali atomi. Näin ollen NA: n ydin+ houkuttelee paljon suurempaa voimaa elektroneihin, joten se vaatii paljon suuremman.
-Elektroninen affiniteetti
Ja lopuksi, sähköisen affiniteetin jaksollinen ominaisuus. Tämä on energiatrendi, jolla on kaasufaasielementin atomi elektronin hyväksymiseksi. Jos atomi on pieni ja siinä on ydin, jolla on suuri vetovoima, sinun on helppo hyväksyä elektroni, muodostaen vakaan anionin.
Mitä vakaampi anioni suhteessa neutraaliin atomiin, sitä suurempi sen elektroninen affiniteetti. Kuitenkin myös samojen elektronien väliset torjut tulevat.
Esimerkiksi typellä on suurempi elektroninen affiniteetti kuin happea. Tämä johtuu siitä, että niiden kolme elektronia 2p katoaa ja hylkää vähemmän toistensa ja tulevan elektronin kanssa; Hapissa ollessaan pari parillisia elektroneja, joilla on suurempi elektroninen torjuminen; Ja fluorissa on kaksi paria.
Tästä syystä elektronisten sukulaisuuksien suuntauksen sanotaan normalisoituvan jaksollisen taulukon kolmannesta jaksosta.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Prof. Ortega graciela m. (1. huhtikuuta 2014). Elementtien säännölliset ominaisuudet. ABC -väri. Haettu osoitteesta: ABC.com.Py
- Kemian librettexts. (7. kesäkuuta 2017). Elementtien ajanjakson ominaisuudet. Palautettu: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D -d. (2. tammikuuta 2019). Elementtien jaksolliset ominaisuudet. Toipunut: Admingco.com
- Toppr. (S.F.-A. Elementtien ajanjaksoominaisuudet. Toipunut: Toppr.com /
- Elementtien jaksolliset ominaisuudet: Matka pöydän yli on matka kemian kautta. [PDF]. Palautettu: COD.Edu
- « Vanhentuneet tekijät, seuraukset ja esimerkit
- Objektiivinen taidehistoria, ominaisuudet, edustajat ja teokset »

