Mikä on kemiallinen jaksollisuus?
- 1272
- 109
- Joshua Emmerich
Se Kemiallinen jaksollisuus Se on trendi tai malli, joka osoittaa kemialliset elementit niiden kemiallisten ja fysikaalisten ominaisuuksien joukossa. Siitä tulee eräänlainen sukulaisuus, joka oli kemian vanhemmille perustuva opas kaikkien nykypäivän tunnetun jaksollisen taulukon elementtien järjestämiseksi ja luokittelemiseksi.
118 olemassa olevaa elementtiä (luonnollisen ja keinotekoisen välillä) pitävät eri määrin suhdetta toisiinsa, jotka määrittelevät ne perheissä tai ryhmissä. Aluksi tämä sai kuvata elementtien reaktiivisuudet sekä muodostuvien yhdisteiden tyyppi; Ja vielä parempi, ennusta niiden niiden ominaisuudet, joita ei ollut vielä löydetty.
 Jaksollisen taulukon elementit
Jaksollisen taulukon elementit Sitten, kun 2000 -luvulla ja fysiikassa eteni, nämä ominaisuudet korreloivat atomin elektronisen rakenteen kanssa. Siten elektronit merkitsevät kemiallista jaksoa elementtien suhteen, mutta ei niinkään niiden isotooppien ja suhteellisen stabiilisuuden suhteen.
Kemiallisen jaksollisuuden ansiosta on mahdollista ymmärtää, miksi elementit sijoitetaan samaan ryhmään jaksollisessa taulukossa. Se mahdollistaa myös kemiallisten ominaisuuksien ennustamisen ja jopa fysikaaliset eri atomimassan elementtien joukossa.
[TOC]
Kuviot ja ryhmät
 Kuten näiden pilvien siksagging -kuviot, elementtien ominaisuudet osoittavat jaksollisen ja ominaisen taipumuksen. Lähde: Pravin Bagga/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Kuten näiden pilvien siksagging -kuviot, elementtien ominaisuudet osoittavat jaksollisen ja ominaisen taipumuksen. Lähde: Pravin Bagga/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Kemiallinen jaksollisuus havaitaan odotetusti jaksollisissa ominaisuuksissa. Näille on ominaista niiden arvojen taipumus, koska niitä arvioidaan jaksollisen ajanjakson tai ryhmän aikana.
Siksak, saha tai jyrkkä vuori voidaan valita vertailutarkoituksiin: ylä- ja alamäet. Toisin sanoen jaksolliset ominaisuudet, joilla on minimaalinen ja maksimi tietyille elementeille. Ja näiden elementtien suhteelliset sijainnit vastaavat loistavasti sijaintia vastaavissa ryhmissä.
Siksi kemiallinen jaksollisuus on hyödyllistä analysoida sitä ryhmien perusteella; Jaksot ovat kuitenkin välttämättömiä täydelliselle näkemykselle trendistä.
Voi palvella sinua: kaliumkarbonaatti (K2CO3): rakenne, ominaisuudet, käyttötarkoitukset, hankkiminenSe nähdään seuraavilla esimerkeillä kemian jaksollisuudesta, mikä ei vain saavuttaa jaksollisia ominaisuuksia, vaan myös epäorgaanisia yhdisteitä ja osallistavia, orgaanisia.
Ionisaatioenergia
Ionisaatioenergia on yksi merkittävimmistä jaksollisista ominaisuuksista. Mitä suurempi elementin atomi, sitä helpompaa sen viimeisimmistä elektroneista on poistaa; toisin sanoen Valencia. Siksi: Atomilla, joilla on pieni radiot.
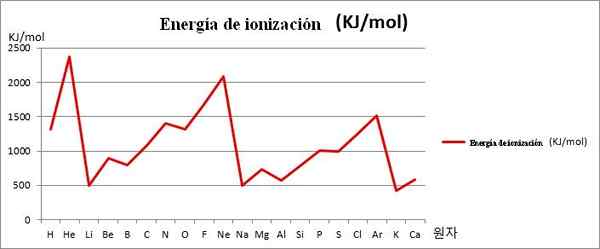 EI vs. grafiikka. Ensimmäiset 20 kemiallista elementtiä. Lähde: Kenneth.JH.Han/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)
EI vs. grafiikka. Ensimmäiset 20 kemiallista elementtiä. Lähde: Kenneth.JH.Han/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Huomaa esimerkiksi yllä olevassa kuvassa, että elementeillä Li, Na: lla ja k: lla on alaikäiset EI, minkä vuoksi ne sijaitsevat grafiikan laaksoissa tai varoissa. Samaan aikaan hänen, NE: n ja AR.
Elementit Li, Na ja K kuuluvat alkalimetallien ryhmään, jolle on ominaista heidän EI -uhrit. Toisaalta, että hän, NE ja AR vastaavat jalokaasuja, erittäin korkeat, koska heidän atomit ovat pienimmät kaikista jaksollisen taulukon saman ajanjakson elementeistä.
Siten kemiallinen jaksollisuus osoittaa, että se vähenee ryhmää, mutta lisää kiertoaksoa vasemmalta oikealle.
Estevesi p
Esimerkki kemiallisesta jaksollisuudesta jaksollisten ominaisuuksien ulkopuolella, joita näemme lohkoelementtien hydroreilla p.
Esimerkiksi ryhmä 15 koostuu elementeistä N, P, AS, SB ja BI. Jos tiedetään, että ammoniakki, NH3, Siinä on typpi, jolla on hapettumismäärä +3, niin on mahdollista odottaa yksinkertaisella jaksollisuudella, että jäljellä olevilla elementeillä on myös samanlaisia hydroja. Ja todellakin se on: NH3, PHE3, Tuhka3, Sbh3 ja BiH3.
Voi palvella sinua: boori: historia, ominaisuudet, rakenne, käyttötarkoituksetToinen vastaava tapaus esiintyy ryhmän 16 kanssa. Happihydridi on h2Tai vesi. Jälleen odotetaan, että elementeillä S, SE, TE: llä ja PO: lla on hydrorit, joilla on yhtä suuret kaavat, mutta epämiellyttäviä ominaisuuksia. Ja se on: h2S, h2Se, h2Te ja h2Poikki. Tämä johtuu kemiallisesta jaksosta.
Ehkä vaikuttavin esimerkki ymmärtää hiili-, pii- ja germanium hydros. Hiilihydridi on CHO4, Ja pii, SIH4. Mendeleevin ennustamalla Germaniolla Eka-Silicio (ES) -nimellä on oltava määräajoin hydridi GEH-kaavan kanssa4; ennuste, joka päätyi vahvistamaan sen löytämisen ja sitä seuraavien tutkimusten jälkeen.
Halogeenimolekyylit
Jos tiedetään, että fluori on alkutilassa m -molekyylinä2, Sitten oletetaan, että muut halogeenit (cl, br, i ja at) muodostavat myös diatomisia molekyylejä. Ja eli CL -molekyylit ovat2, Br2 ja minä2 Tunnetuin.
Oksidit ja sulfidit
Samoin kuin Block Hydrorsilla mainitaan p, Saman ryhmän elementtien oksidit ja sulfidit osoittavat eräänlaista vastaavuutta vastaavissa kemiallisissa kaavoissa. Esimerkiksi litiumoksidi on Li2Tai oksidit muille alkalisille metalleille tai ryhmälle 1: NA2OKEI2Tai RB2O ja CS2JOMPIKUMPI.
Tämä johtuu siitä, että kaikissa metallit, joiden hapettumismäärä +1, ovat vuorovaikutuksessa anionin kanssa tai2-. Sama tapahtuu heidän sulfidiensa kanssa: Li2S, na2S jne. Alkalinottimien metallien tai ryhmän 2 tapauksessa niiden oksidien ja sulfidien kaavat ovat vastaavasti: BEE ja BES, MGO ja MGS, CAO ja CAS, SRO ja SRS, Bao ja BAS.
Se voi palvella sinua: Selenaryhappo (H2SO3): Ominaisuudet, riskit ja käytötTätä määräajoin sovelletaan myös (osittain) lohkoelementtien oksideihin p: Co2, Sitoa2, Geo2, B -2JOMPIKUMPI3, Siihen2JOMPIKUMPI3, Ga2JOMPIKUMPI3, jne. Kuitenkin lohkoelementteille d -d tai muut lohkosta p, Tämä jaksollisuus muuttuu monimutkaisemmaksi, koska saman elementin mahdolliset mahdolliset hapettumisluvut ovat.
Esimerkiksi kupari ja hopea kuuluvat ryhmään 11. Yhdessä on kaksi oksidia: CuO (Cu2+) ja cu2Tai (cu+) Vaikka toisella tuskin on vain yksi: AGO (AG+-A.
Hiilivedyt ja silaanit
Sekä hiilellä että piillä on kyky muodostaa vastaavasti C- tai Si-Si-sidoksia. C-C-sidokset ovat paljon vakaampia, joten hiilivetyrakenteet voivat muuttua suhteettoman lukuisampia ja monipuolisempia kuin niiden siltanien kollegoja.
Tämä johtopäätös johtuu jälleen kemiallisesta jaksollisuudesta. Esimerkiksi etaani, cho3CH3 tai c2H6 Disilanumilla on vastine, SIH3Kyllä h3 tai jos2H6.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Helmestine, Anne Marie, PH.D -d. (26. elokuuta 2020). Periody -määritelmä kemiassa. Toipunut: Admingco.com
- JA. V. Babaev, ja Ray Hefferlin. (S.F.-A. Kemiallisen jaksollisuuden käsite:
Mendeleev-molekyylipöydän hyperjaksokuvioista. Palautettu: Chem.MSU.Rulla - Kukkas., Theopold k., & Langley R. (S.F.-A. Periody. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Avoin yliopisto. (2020). Kemialliset kuviot löytyvät kauden taulukosta: kemiallinen jaksollisuus. Palautettu: Avoin.Edu

