Chimotripsin -ominaisuudet, rakenne, toiminnot, toimintamekanismi
- 3525
- 725
- Alonzo Kirlin
Se kikaripsin Se on haiman toiseksi runsas ruuansulatusproteiini ohutsuolta kohti. Se on seriiniproteeajen perheeseen kuuluva entsyymi ja erikoistuu peptidisidosten hydrolyysiin aminohappojen, kuten tyrosiinin, fenyylialaniinin, tryptofaanin, menetelmän ja leukiinin välillä.
Nimi "kemotripsiini" yhdistää itse asiassa ryhmän entsyymejä, joita haima tuottaa ja jotka osallistuvat aktiivisesti eläinten proteiinien suolistoon. Sana johtuu reniinin toiminnasta, joka tällä entsyymillä on mahalaukun pitoisuuteen tai "Chimo".
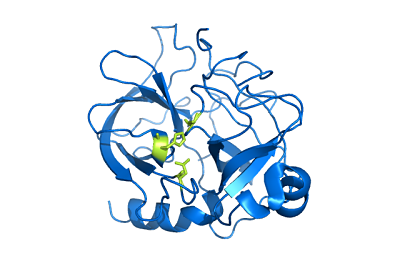
 Chimotripsin -rakenne (lähde: Käyttäjä: Mattyjenjenren [määritys] Wikimedia Commonsin kautta)
Chimotripsin -rakenne (lähde: Käyttäjä: Mattyjenjenren [määritys] Wikimedia Commonsin kautta) Vaikka ei tiedetä tarkalleen, kuinka laaja sen jakautuminen on eläinvaltakunnassa, katsotaan, että näitä entsyymejä esiintyy ainakin kaikissa karitsoissa ja niiden läsnäolosta on ilmoituksia "primitiivisemmissä reunoissa", kuten niveljalkaiset ja Celestroads.
Niissä eläimissä, joilla on haima, tällainen elin on Chimotripsine -tuotannon pääpaikka, samoin kuin muut proteaasit, entsymaattiset estäjät ja esiasteet tai zimogeenit.
Chimotripsiinit ovat tutkituimpia ja parempia karakterisoituja entsyymejä paitsi suhteessa niiden biosynteesiin, myös sen aktivoitumiseen zimogeenista, sen entsymaattisista ominaisuuksista, sen estämisestä, sen kineettisistä ja katalyyttisistä ominaisuuksista ja sen yleisestä rakenteesta.
[TOC]
Ominaisuudet ja rakenne
Chimotripsiinit ovat endopeptidaaseja, ts. Ne ovat proteaaseita, jotka hydrolysoivat aminohappojen peptidisidoksia muiden proteiinien ”sisäisissä” asemissa; Vaikka on myös osoitettu, että he voivat hydrolysoi estereitä, amidasia ja arilamidoja, vaikkakin vähemmän selektiivisyydellä.
Niiden keskimääräinen molekyylipaino on noin 25 kDa (245 aminohappoa) ja ne on valmistettu esiasteista, jotka tunnetaan nimellä kemotripsinogeenit.
Naudan eläinten haimasta on puhdistettu 2 tyyppiä kemotripsinogeenejä, A ja B. Sikamallissa kuvattiin kolmas kemotripsinogeeni, kuvattiin chimotripsinogeeni C. Jokainen näistä kolmesta zimogeenistä on vastuussa kikimotropsiinien A, B ja C tuotannosta.
Se voi palvella sinua: Quintana Roo Flora ja eläimistöChimotripsiini A muodostuu kolmella polypeptidiketjulla, jotka on kovalenttisesti kytketty toisiinsa siltojen tai disulfidisidosten kautta kysteiinitähteiden välillä. On kuitenkin tärkeää mainita, että monet kirjoittajat pitävät sitä monomeerisenä entsyyminä (koostuu yhdestä alayksiköstä).
Nämä ketjut muodostavat rakenteen, jolla on ellipsoidimuoto, jossa ryhmät, joissa on sähkömagneettisia kuormia.
Yleisesti.
Kemotripsiinitoiminnot
Kun eksokriinisiä haimaa stimuloidaan joko hormonien tai sähköisten impulssien avulla, tämä elin vapauttaa erittyviä rakeita, joissa on runsaasti kemotripsinogeeniä, joka saavuttaa ohutsuoleen, leikataan toisella proteaasilla 15 ja 16 ja sitten ”automaattisesti syytettyä” suorittamiseksi " täysin aktiivinen proteiini.
Ehkä tämän entsyymin päätehtävä on toimia yhdessä muiden erittyneiden proteaasien kanssa kohti maha -suolikanavan järjestelmää ruuan ruuansulatukseen tai hajoamiseen.
Tällaisen proteolyysin tuotteet toimivat myöhemmin hiilen ja energian lähteenä aminohappojen katabolismin kautta tai ne voidaan “kierrättää” suoraan uusien soluproteiinien muodostumiseksi, joilla on useita ja monipuolisia funktioita fysiologisella tasolla.
Toimintamekanismi
Chimotripsiinit käyttävät toimintaansa vasta aktivoinnin jälkeen, koska ne tuotetaan "esiasteena" (zimogeeninä), jota kutsutaan kemotropsinogeeniseksi.
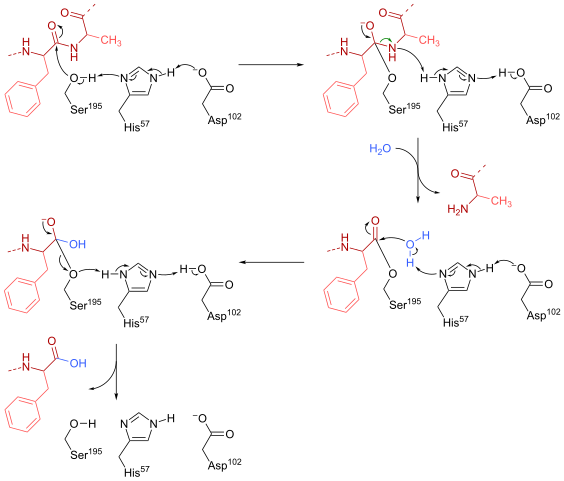 Quimotripsin -reaktiomekanismi (lähde: HBF878 [CC0] Wikimedia Commonsin kautta)
Quimotripsin -reaktiomekanismi (lähde: HBF878 [CC0] Wikimedia Commonsin kautta) Koulutus
Haiman acinaarisolut syntetisoivat kimotripsiinin zimogeenit, minkä jälkeen ne siirtyvät endoplasmisesta retikulumista Golgi -kompleksiin, missä ne on pakattu kalvojen komplekseihin tai eritysrakeisiin.
Voi palvella sinua: biologiaan liittyvät tieteetNämä rakeet kerääntyvät acinon päihin ja vapautuvat vasteena hormonaalisille ärsykkeille tai hermoimpulsseille.
Aktivointi
Aktivointiolosuhteista riippuen voidaan löytää monen tyyppisiä kimotripsiineja, mutta ne kaikki merkitsevät peptidilinkin proteolyyttistä "leikkausta" zimogeenissä, kimotripsinogeenissä, entsyymi -tripsiinin katalysoimassa prosessissa, jota tripsiini.
Aktivointireaktio koostuu alun perin aminohappojen 15 ja 16 välisestä leikkaussidoksesta, joka muodostaa π-quimotripsiinin, joka kykenee ”itseprosessin” ja täydellisen autokatalyysin aktivoinnin.
Tämän viimeisen entsyymin vaikutus edistää sen jälkeen peptidien muodostumista yhdessä C-terminaalisen ketjun avulla, joka alkaa jäännöksellä 149).
Jätettä 14-15 ja 147-148 (kahdella dipéptides) vastaavilla annoksilla ei ole katalyyttisiä funktioita ja irrottaminen päärakenteesta.
Katalyyttinen aktiivisuus
Chimotripsiini on vastuussa peptidisidosten hydrolysoinnista, hyökkääen pääasiassa aminohappojen karboksyyliosaan, joilla on aromaattisia sivuryhmiä, toisin sanoen aminohapot, kuten tyrosiini, tryptofaani ja fenyylianiini.
Tämän tyyppisten entsyymien aktiivisessa paikassa (gly-asp-sarjan gly-glu-al-val) aktiivisessa paikassa (gly-asp-series-gly-glu-ala-valssa on ehkä sen operaation välttämättömä jäännös. Reaktiomekanismi on seuraava:
- Chimotripsinia löytyy alun perin "substraatin vapaalta" muodossa, jossa katalyyttinen "triadi" koostuu aspartaattijäännöksen (102) lateraalisesta karboksyyliryhmästä, histidiinitähteen imidatsolirenkaasta (57) ja ryhmäpuolen hydroksyylistä Seriini (195).
- Substraatti täyttää entsyymin ja liittyy tähän muodostaen tyypillisen entsyymin substraatin palautuvan kompleksin (Micaelian mallin mukaan), jossa katalyyttinen ”kolmikko” helpottaa nukleofiilistä hyökkäystä aktivoimalla seriiniseriinin hydroksyyliryhmä.
Se voi palvella sinua: Typen emäkset: Mitä ovat, luokittelu, toiminnot- Reaktiomekanismin avainkohta koostuu osittaisen yhteyden muodostumisesta, mikä johtaa hydroksyyliryhmän polarisaatioon, mikä riittää reaktion kiihdyttämiseen.
- Nukleofiilisen hyökkäyksen jälkeen karboksyyliryhmästä tulee tetraedrinen Oxianion -välittäjä, joka stabiloituu kahdella vety sillalla, jotka muodostuvat Gly -jäännöksen ryhmien N ja H, 193 ja 195 ollessa 195.
- Oksyanioni on spontaanisti "uudelleenjärjestely" ja muodostuu entsymaattinen välittäjä, johon asyyliryhmä on lisätty (RACYLED -entsyymi).
- Reaktio jatkuu saapuessaan vesimolekyyliä aktiiviseen kohtaan, molekyyli, joka edistää uutta nukleofiilistä hyökkäystä, joka johtaa toisen tetraedrisen välittäjän muodostumiseen, joka myös stabiloituu vety silloilla.
- Reaktio päättyy, kun tämä toinen välittäjä järjestetään uudelleen uudelleen ja muodostaa jälleen entsyymin substraatti-micaelian-kompleksin, jossa entsyymin aktiivinen paikka on karboksyyliryhmän sisältämä tuote.
Viitteet
- Appel, W. (1986). Kymotrypsiini: molekyyli- ja katalyyttiset ominaisuudet. Kliininen biokemia, 19 (6), 317-322.
- Taivutus, m. Lens., Killheffer, J. V., & Cohen, S. (1973). Tymotrypsiini. CRC: n kriittiset arvostelut biokemiassa, 1 (2), 149-199.
- Puhaltaa, D. M. (1971). 6 Kymotrypsiinin rakenne. Entsyymeissä (Vol. 3, pp. 185-212). Akateeminen lehdistö.
- Puhaltaa, D. M. (1976). Kymotrypsiinin rakenne ja mekanismi. Kemiallisen tutkimuksen tilit, 9 (4), 145-152.
- Nelson, D. Lens., Lehninger, a. Lens., & Cox, M. M. (2008). Lehninger -biokemian periaatteet. Macmillan.
- Polgár, l. (2013). Seriini- ja treoniinipeptidien katalyyttiset mekanismit. Proteolyyttisten entsyymien käsikirjassa (PP. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Hypoteesi kymotrypsiinin vaikutusta koskevalle mekanismille. Amerikan yhdysvaltojen kansallisen tiedeakatemian julkaisut, 43 (11), 969.
- « Bentsyylihapposynteesi, transpositio ja käyttö
- Visuaalinen oppimisominaisuudet, strategiat, aktiviteetit, esimerkit »

