Synteesireaktiotyypit, tekijät, esimerkit
- 2482
- 533
- Gustavo Runte DVM
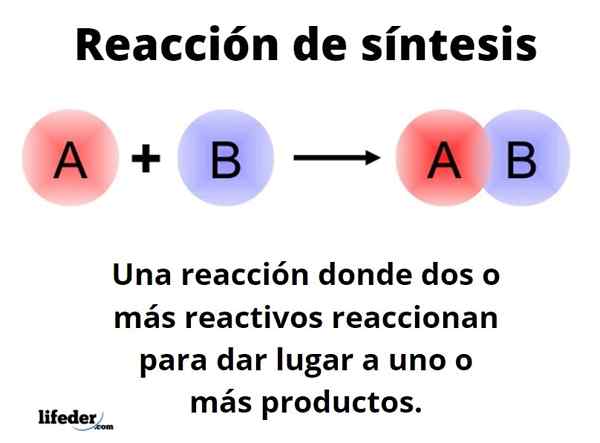
Se Synteesireaktio Se on yksi, jossa kaksi tai useampia reagensseja reagoi kykenevänsä perustamaan kvantitatiivisesti yhden tai useamman tuotteen joko laboratorio- tai teollisuustasolla. Tämä on yksi kemian perustavanlaatuisimmista reaktioista, ja sen tyypit ja mallit rajoittuvat melkein äärettömyyteen.
Yleinen tapa voidaan esittää lomakkeella: A+B → C. Yksinkertaisessa synteesireaktiossa reagenssi reagoi toisen B -reagenssin kanssa C -tuotteen tuottamiseksi. Sanotaan, että se koostuu yhdestä vaiheesta. Voi kuitenkin tapahtua, että reagoida ensin E: n kanssa, jota seuraa F ja lopulta G: n kanssa (muut reagenssit), muuttuu tuotteiksi C; eli sama reaktio tapahtuu useissa vaiheissa.

Yhdestä vaiheesta tai monista riippumatta, kaikki synteesireaktiot perustuvat tehokkuuteen (termodynamiikka ja kineettinen), joiden kanssa reagenssit reagoivat muuttumiseen tuotteiksi, samoin kuin kokeellinen suorituskyky. Toivotaan, että synteesireaktio kulkee onnistuneesti ja tuottaa mahdollisimman paljon tuotteita.
[TOC]
Synteesireaktiotyypit
Yksinkertainen tai useita
Synteesireaktioita ei ole täysin helppo luokitella. Se voi olla kemistin kriteereihin liittyvä ongelma. Koska? Oletetaan, että edellä kommentoitava monireaktio:
A + E → P1
P1 + F → p2
P2 + G → c
P -oleminen1 Ja p2 välittäjät, jotka eivät ole kiinnostavia. Tuotteen synteesin tai yhdisteen C reaktio, joka alkaa A: sta pääreagenssina (reagenssin rajoittaminen tai rajoittaminen), on useita tai monimutkaisia, koska se tapahtuu useissa vaiheissa, joissa muut reagenssit osallistuvat: E, F ja G.
Jokainen edellisestä kolmesta reaktiosta voi koostua ja tyyppinen kemiallinen reaktio itsessään. Toisin sanoen synteesireaktio voi olla minkä tahansa muun tyyppisiä kemiallisia reaktioita (kaksinkertainen siirtymä, redox, palaminen, neutralointi, nitraatio, substituutio jne.), niin kauan kuin tuote on peräisin ja siihen liittyy kokeellinen suorituskyky.
Niin:
A + E → P1
Sitä voidaan pitää yksinkertaisena synteesireaktiona tuotteelle P1, Riippumatta siitä, millaista reaktiotyyppiä on. Ja myös:
P1 + F → p2
Se on toinen yksinkertainen synteesireaktio tuotteelle P2.
Epäorgaaninen tai orgaaninen
Synteesireaktiot voivat olla kaikenlaisia reaktion luonteen ja sen molekyylimekanismin suhteen. Ne voidaan kuitenkin jakaa reagenssien ja tuotteiden kemiallisen luonteen mukaan.
Voi palvella sinua: Natriumasetaatti: rakenne, ominaisuudet, synteesi, käyttöEsimerkiksi, jos reagenssit ovat epäorgaanisia aineita, puhumme epäorgaanisesta synteesistä; Vaikka ne olisivat orgaanisia aineita, puhumme jo orgaanisesta synteesistä.
Orgaanisen synteesin kenttä on kolossaalinen, koska se kattaa lääkkeiden, väriaineiden, muovien, hyönteismyrkkyjen, liimojen, hajusteiden, säilöntäaineiden tuotannot tuhansien muiden tuotteiden joukossa.
Synteesireaktioihin liittyvät tekijät
Synteesireaktioihin liittyvät tekijät ovat kaikki nämä parametrit tai muuttujat, fysikaaliset ja kemikaalit, jotka vaikuttavat suoraan alkuperäisten tuotteiden reaktion suorituskykyyn ja laatuun. Jotkut heistä ovat seuraavia:
Lämpötila
Lämpötila on välttämätön missä tahansa synteesireaktiossa. Termodynamiikasta riippuen voi olla kätevää, että se pysyy matalana tai korkeana. Samoin lämpötiloissa on alueita, joissa ei -toivotut sivuttaisreaktiot ovat todennäköisiä, joten on välttämätöntä hallita sitä ja vahvistaa se jatkuvasti.
Aika
Aika on välttämätöntä myös synteesireaktioissa, koska sen on varmistettava, että se riittää tasapainon perustamisen takaamiseksi. Tietyn ajan kuluttua enemmän tuotetta lakkaa saamisesta, ja silloin synteesi päätetään lopettaa kokonaan.
Reagenssien pitoisuudet ja laatu
Mitä keskittyneempi reagenssit ovat, sitä nopeammin reaktiot ovat. On kuitenkin myös välttämätöntä olla selvää sen pitoisuuksien ja sen suuruuksien osuudesta, koska minimimuutos vaikuttaa lopulliseen suorituskykyyn.
Toisaalta reagenssien on oltava mahdollisimman puhtaita, muuten virheelliset pitoisuudet oletetaan; Tai mikä pahempaa, tuotteet ovat saastuneita tai ei -toivottuja reaktioita tapahtuu.
Levottomuus
Tapa, jolla reaktioväliaine sekoitetaan.
Paine
Paine, kuten pitoisuus, on ratkaiseva rooli, etenkin kun reagenssit ovat soodalajeja tai aineita. Mitä suurempi paine, sitä suuremmat reagenssien törmäykset tai vuorovaikutukset ja siksi todennäköisemmin reagoivat.
PHE
PH (happo tai emäksinen) vaikuttaa suoraan reaktion mekanismiin, joten se on avaintekijä määrittelemällä, mitkä tuotteet saadaan synteesin lopussa.
Voi palvella sinua: kiehumiskohta: Konsepti, laskenta ja esimerkitKatalyytit
Katalyyttit ovat aineita, jotka kiihdyttävät kemiallisia reaktioita, mutta ilman kulutettuja prosessin aikana. On synteesi, että ilman interventiota se olisi mahdotonta.
Synteesireaktiot esimerkkejä
Seuraavaksi ja lopuksi mainitaan useiden yhdisteiden synteesireaktioiden kemialliset yhtälöt.
Pöytäsuola (natriumkloridi)
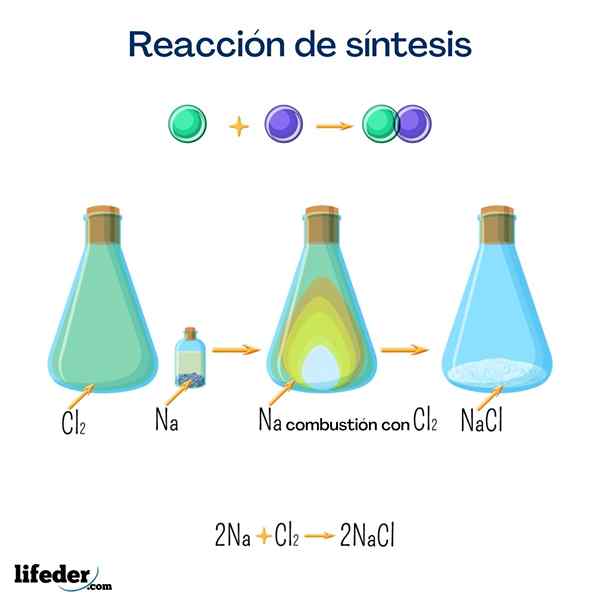
Tämä suola on yksi kaikkien tunnetuimmista suuresta kotimaan käytöstä. Se saadaan natriumista ja kloorista, ja vaikka se voidaan saada seuraavalla reaktiolla, on erittäin helppo löytää se luonnollisesti.
2 Na+Cl 2 → 2 NaClGlukoosi
Tämä on yksi tärkeimmistä reaktioista elämän olemassaoloon sellaisena kuin me sen tiedämme. Kasvit käyttävät hiilidioksidia ja ympäristöympäristöä auringonvalolla glukoosin ja hapen tuottamiseksi.
Reaktio erittäin yleisesti voidaan nähdä alla, mutta on tärkeää ymmärtää, että sen takana on useita reaktioita ja mekanismeja, jotta tämä olisi mahdollista.
6CO2 + 6H2O → C6H12O6 + O2
Sakkaroosi
Tämä synteesireaktio tapahtuu elävissä organismeissa ja se annetaan polymeroivan glukoosia fruktoosin kanssa. Rakenteensa vuoksi nämä kaksi molekyyliä ovat vuorovaikutuksessa ja lopputulos on sakkaroosi ja vesi, kuten seuraavassa yhtälössä voidaan nähdä:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Ammoniakki
3 h2(g) + n2(g) → 2 NH3(g)
Reagenssit h2 ja n2 Ne ovat kaasumaisia. Paineen on oltava korkea, jotta molekyylit reagoivat ja lähtemään ammoniakkiin, NH3. Tämä on yksi teollisuuskemian tärkeimmistä synteesireaktioista.
Vettä
2 h2(g) + tai2(g) → 2 h2O (g)
H2 Minä2 reagoi eksotermisesti vesihöyryn tuottamiseksi. Vapautuvan energian määrä on sellainen, että vety on yksi lupaavimmista polttoaineista ilmailu-.
Alkoholi
C2H4(g) + h2Tai (l) → Cho3CH2Voi (l)
Etanolia kutsutaan alkoholiksi, vain yksi monista olemassa olevista alkoholista. Sen synteesireaktio koostuu eteenin hydraatiosta, c2H4 tai h2C = ch2, missä vesimolekyyli lisätään kaksoissidokseen.
Rikkihappo
Rikkihapolla on useita tehokkaita synteettisiä reittejä. Yksinkertaisin koostuu kuitenkin useista vaiheista:
Voi palvella sinua: karboksimetyyliselluloosaS (s) +o2(g) → niin2(g)
2 niin2(g)+tai2(g) ⇌ 2 niin3(g)
Sw3(g)+h2Tai (l) → H2Sw4(g)
H2Sw4(g) → H2Sw4(L)
Rikki palaa ylimääräisellä happella ensin muuttumaan niin2, Ja sitten niin3. Sitten niin3 on hydratoitunut tuottamaan H -höyryjä2Sw4, joka lopulta tiivistää h2Sw4 nestemäinen. Tämä synteesi on niin tärkeä, että se itsessään osoittaa kuinka vahva.
Metanoli
Co (g) + 2 h2(g) → ch3Voi (l)
Gases Co ja H2 reagoi ja tiivistä metallikatalyyttejä metanolin, kaikkien yksinkertaisimman alkoholin aiheuttamiseksi.
Magnesiumsulfaatti
Se voi tapahtua hyvin yksinkertaisesta reaktiosta, joka koostuu magnesiumista ja rikkihaposta. On erittäin vaikea löytää sitä luonnosta ilman vettä.
Mg + H2SO4 → H2 + MGSO4
Hiilidioksidi
Se tapahtuu luonnollisesti useissa prosesseissa, kun hiilidioksidia tuotetaan hiilidioksidimolekyylillä.
Sitä esiintyy luonnollisissa prosesseissa, kuten hengitys, fotosynteesin reagenssina ja tapahtuu helposti palamisreaktioissa.
C +O2 → CO2
Suolahappo
Kloorivetyhappoa käytetään laajalti halpana happona ja reaktiivisena aineena muiden yhdisteiden synteesiä varten.
CL2+H2 → 2HCL
Kalsiumkarbonaatti
Sitä tunnetaan laajasti erittäin runsas agentti luonnossa, pääasiassa kivissä, mineraaleissa ja kuorissa meressä. Sen reaktio perustuu kalsiumoksidin vuorovaikutukseen hiilidioksidin kanssa.
CAO +CO2 → CaCO3
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10th Painos.-A. Wiley Plus.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Morrison ja Boyd. (1987). Orgaaninen kemia. (Viides painos). Addison-Wesley Iberoamericana.
- Metler Toledo. (S.F.-A. Synteesireaktiot. Toipunut: MT.com
- Helmestine, Anne Marie, PH.D -d. (27. elokuuta 2020). Synteesireaktion kuvaus plus kokeet. Haettu ajatuskosta.com
- Wikipedia. (2020). Kemiallinen synteesi. Haettu: vuonna.Wikipedia.org
- Danielle Reid. (2020). Synteesireaktio: Määritelmä, kaava ja esimerkki. Opiskelu. Toipunut: Opiskelu.com

