Oktettisääntö

- 4025
- 1270
- Gabriel Fahey
 Hiilidioksidimolekyylin esitys, joka osoittaa Octet -säännön noudattamisen
Hiilidioksidimolekyylin esitys, joka osoittaa Octet -säännön noudattamisen Mikä on oktettisääntö?
Se Oktettisääntö Se on käytännöllinen sääntö, joka selittää edustavien elementtien kemiallisen sidoksen muodostumisen sen valenssikerroksen elektronisen kokoonpanon perusteella.
Tämän säännön mukaan atomit yhdistyvät toisiinsa siten, että jokaista atomia ympäröi kahdeksan elektronia sen valenssikerroksessa (siis sana oktetti).
Tämä sääntö julkaistiin samanaikaisesti 1.916 Sekä Gilbert Lewis että Walther Kossel. Se heijastaa havaintoa, että jalokaasut ovat erittäin vakaita ja kaikki heliumia lukuun ottamatta, niille on ominaista, että niiden valenssikerros on 8 elektronia.
Teoriassa todetaan, että atomit jakavat tai vaihtavat elektroneja muodostamalla kemiallisia sidoksia tämän täyden lefoer -elektronisen kokoonpanon hankkimiseksi.
Octet Rule- ja Lewis -rakenteet
Octet -sääntö- ja Lewis -rakenteet ovat läheisesti sukulaisia. Tämä johtuu siitä, että Octet -sääntö on yksi emäksistä kemiallisen sidoksen muodostumisen ymmärtämiseksi, joten se sallii ennustaa useimmissa tapauksissa kemikaalien Lewisin rakenteen.
Tässä mielessä yksi tärkeimmistä vaiheista Lewis -rakenteen piirtämiseksi, sen jälkeen, kun kaikki molekyylin muodostavien atomien välille on sijoitettu yksinkertaisia linkkejä, on jakaa jäljellä olevat valenssielektronit useimpien elektronegatiivisten atomien joukossa niiden oktettien loppuun saattamiseksi loppuun.
Tapauksissa, joissa oktetit ovat täyttämättä, muodostetaan kaksinkertainen tai kolminkertainen sidos, etsivät aina oktettisääntöä mahdollisimman monta atomia. Joten tämä empiirinen sääntö on välttämätön Lewis -rakenteiden rakentamiselle.
Se voi palvella sinua: Silver Yoduro (AGI): rakenne, ominaisuudet, hankkiminen, käyttöEsimerkkejä oktettisäännön noudattamisesta
Oktetti -sääntöä sovelletaan pääasiassa edustaviin elementteihin, toisin sanoen jaksollisen taulukon S- ja P -lohkoihin. Tätä sääntöä sovelletaan johdonmukaisesti yhdisteisiin, jotka sisältävät hiiltä, typpeä, happea ja halogeeneja, ja joitain lukuun ottamatta P -lohkon muita elementtejä. Useimmat siirtymämetallit eivät kuitenkaan noudata.
Joitakin esimerkkejä yhdisteistä, joissa oktettisääntö täyttyy kaikille atomeille, ovat:
Hiilidioksidi (CO2-A
Kuten alla esitetyn hiilidioksidin Lewis -rakenteessa voidaan nähdä, sekä keskushiili että molemmat happiatomit noudattavat oktettisääntöä.
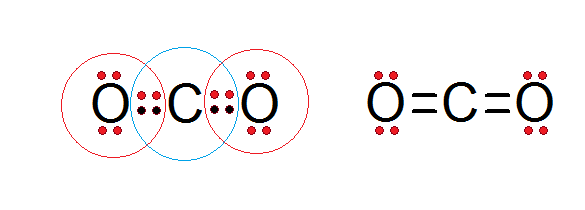
Hiiltä ympäröi sen 4 valenssielektronia sekä kaksi elektronia jokaisesta happesta, jotka vaikuttavat kaksoissidoksista c = o, kun taas jokaista happea ympäröi 6 omaa elektronia sekä pari hiilestä.
Neopentano (C5H12-A
Suurimmassa osassa orgaanisia yhdisteitä kaikki atomit täyttävät oktettisäännön (paitsi vety, jota ympäröivät vain 2 elektronia). Tähän sisältyy alkaania, kuten Neopentano tai 2,2-dimetyylipropaani:
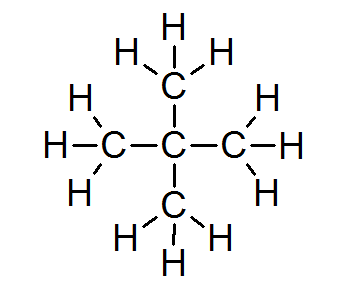
Tässä tapauksessa voidaan myös nähdä, että jokaisella hiiliatomilla on neljä elektroniaan neljällä naapuriatomilla, joista kukin tarjoaa yhden elektronistaan muodostamaan 4 yksinkertaista kovalenttista sidosta, jotka pitävät yhdessä.
Tästä syystä jokaista hiiliatomia ympäröi 8 valenssielektronia, jotka noudattavat oktettisääntöä.
Voi palvella sinua: aktivointienergiaHiilimonoksidi (CO)
Hiilimonoksidi on toinen molekyyliyhdiste, jossa happea ja hiili -elektroneja muodostavat kovalenttisen sidoksen oktettisäännön täyttämiseksi.
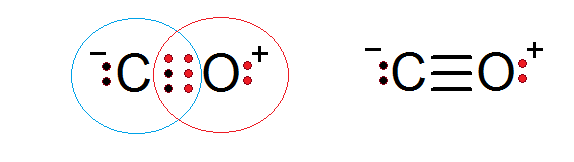
Tässä tapauksessa hiili tarjoaa kaksi elektronia ja happea 4 kuuden elektronin loppuun saattamiseksi, jotka tarvitaan niiden yhdistäneen kolminkertaisen kovalenttisen sidoksen muodostamiseksi. Kummassakin atomista on ylimääräisiä elektroneja jakamatta kutakin oktettia.
Nitraatti -anioni (ei3--A
Myös ionien tapauksessa oktettisääntö täyttyy. Nitraatti -ionilla on keskus typpiatomi, jota ympäröivät 3 happiatomia.
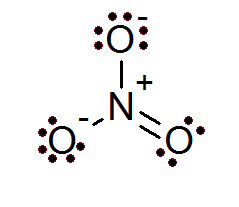
Kuten tässä tapauksessa voidaan nähdä, kaikilla atomeilla on täysi oktetti, kahdella happea on negatiivinen muodollinen kuorma, kun taas typellä on positiivinen muodollinen kuorma, mikä johtaa -1 -nitraatti -ionin nettokuormitukseen.
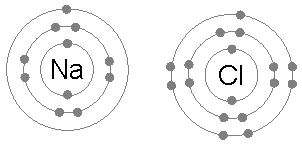
Natriumkloridi (NaCl)
Elektronien vaihto ionisten yhdisteiden muodostamiseksi on myös yleinen esimerkki oktettisäännön soveltamisesta.
Kun natriumkloridi muodostuu kloorista ja natriumista, se alkaa kahdesta atomista, jotka eivät noudata oktettisääntöä, koska elektronilla ja kloorilla ei ole natriumia sen oktettinsa loppuun saattamiseksi.
Sitten natrium antaa elektronin klooriin, jättäen kationin 8 elektronia ympäröimänä ja puolestaan täydentämällä oktetin klooriin muodostamalla kloridi -ioni.
 Poikkeuksia oktettisäännöstä
Poikkeuksia oktettisäännöstä
Aivan kuten on olemassa suuri joukko yhdisteitä, joissa kaikki atomit täyttävät oktettisäännöt, on myös useita esimerkkejä atomista, jotka eivät noudata sitä.
Se voi palvella sinua: potentiaalinen Z: arvot, hyytymisasteet, määritys, käyttöJotkut ympäröivät alle 8 elektronia, joten ne ovat köyhät elektronilajit, kun taas toisia ympäröi yli kahdeksan elektronia, jolloin sanotaan, että sillä on laajennettu oktetti tai sitä kutsutaan Hypervalenttinen atomi.
Esimerkkejä huonoista elektronilajeista
Bordean (BH3-A
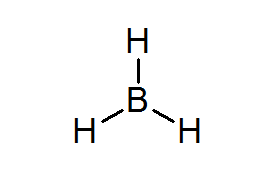
Tämä yhdiste on tyypillinen esimerkki huonoista elektroneista. Boori tai ympäröivillä vetyillä ei ole tarpeeksi elektroneja, jotta voidaan tyydyttää oktettisääntö keskusatomisessa. Tämä saa boorin vastaanottamaan pari elektronia toisesta atomista toisessa molekyylissä, muuttamalla bordealihappo Lewisin hapoksi.
Alumiinitriklurur (Alcl3-A
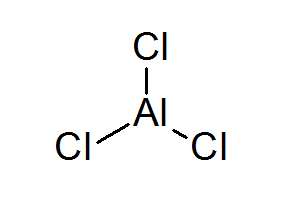
Alcl3 Se on toinen esimerkki Lewis -happosta, joka velkaa kemiallisen käyttäytymisensä, jolle se ei täytä oktettisääntöä.
Esimerkkejä hypervaluenteista
Rikkiheksafluoruro (SF6-A
Tyypillinen esimerkki laajennetusta oktetista on SF6, jota yleensä esitetään keskusrikinä, jossa on 6 yksinkertaista kovalenttista sidosta fluoriatomilla. Tässä tapauksessa rikkiä ympäröi 12 valenssielektronia 8: n sijasta, joten se rikkoo oktettisääntöä.
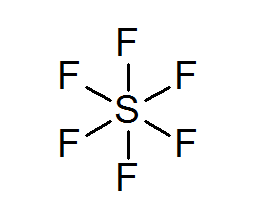
Tästä huolimatta on ehdotettu malleja, joissa rikki on tosiasiallisesti kytketty kovalenttisiin sidoksiin 4 fluoreen samanaikaisesti, kun taas kahden muun muodossa ioniset sidokset. Jos niin, se täyttää oktettisäännön.
Fosforipentakloridi (PCL5-A
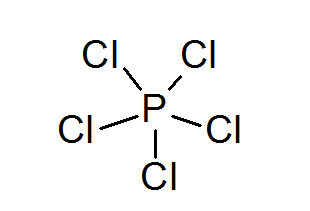
Kuten rikin tapauksessa, fosfori voi myös muodostaa yhdisteitä, joissa on laajennettuja oktetteja, tässä tapauksessa 10 elektronia ympäröimänä.

