Aufbaun periaate

- 3321
- 605
- Dr. Travis Reichert
 Atomien kiertoratojen täyttämismääräys Aufbaun periaatteen mukaisesti
Atomien kiertoratojen täyttämismääräys Aufbaun periaatteen mukaisesti Mikä on Aufbaun periaate?
Hän Aufbaun periaate, Tunnetaan myös sateiseksi sääntö- tai rakennusperiaatteeksi, se on käytännöllinen sääntö, joka sallii ennustettavan suurimman osan jaksollisen taulukon elementtien ja sen ionien elementtien elektronisen kokoonpanon.
Tämä periaate vahvistaa, että kun ytimeen lisätään protoneja, yksi kerrallaan peräkkäin jokaisen kemiallisen elementin rakentamiseksi, elektronit lisätään peräkkäin myös vähiten energiaatomien kiertoradalle, joita on saatavilla.
Toisin sanoen Aufbau totesi, että on olemassa erityinen järjestys, jonka mukaan atomiorbitaalit voidaan täyttää. Tämä tilaus selitetään alla.
Orbitaalien täyttämisjärjestys Aufbaun periaatteen mukaisesti
Atomiorbitaalien täytettävä järjestys riippuu niiden energiatasosta. Kultainen sääntö on, että nämä energiatasot täytetään vähiten suurimpaan, ikään kuin se olisi rakennus, jossa huoneistot tulisi täyttää alimmilla kerroksilla korkeimpien kerroksien pääsemiseksi.
Tässä mielessä orbitaalien täyttämisjärjestyksen ennustamiseksi meidän on ensin tiedettävä, kuinka ne tilataan heidän energiatasonsa mukaan. Rakennusanalogiassa tämä tarkoittaa tietämistä, mitkä (kiertoradan) huoneistot ovat jokaisessa kerroksessa.
Seuraava grafiikka näyttää ensimmäisten atomiorbitaalien energiatasot, jotka on järjestetty alhaisimmasta suurempaan energiaan.
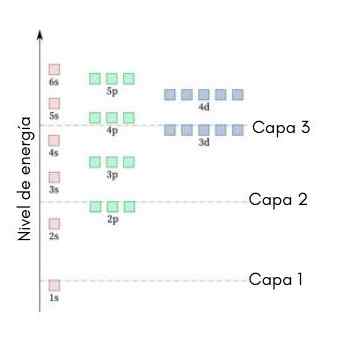
Tässä kuvassa kukin kuva edustaa tiettyä kiertorata, jossa vain 2 elektronia sopii. Jokainen samanvärisen maalausryhmä edustaa energiatasoa.
Nämä alataso tunnistetaan numerolla ja kirjaimella (1S, 3P, 3D, jne.-A. Numero osoittaa pääenergiatason, kun taas kirjain ilmaisee ryhmätyypin, joka muodostaa ryhmän.
Se voi palvella sinua: alumiinikloridi (ALCL3)Tämän järjestelmän mukaan ensimmäinen täytettävä alataso on 1s (kaikkien vähiten energia), sitten 2S, 2P, 3S, 3P, 4S, 3D ja niin edelleen.
Sadesääntö
Huolimatta siitä, kuinka helppoa on vahvistaa täyttöjärjestys, jos sinulla on edellisen kuvaaja, on vaikea muistaa tiet. Tätä varten käytetään "sateen sääntöä".
Tämä sääntö koostuu kahdesta yksinkertaisesta vaiheesta:
Vaihe 1
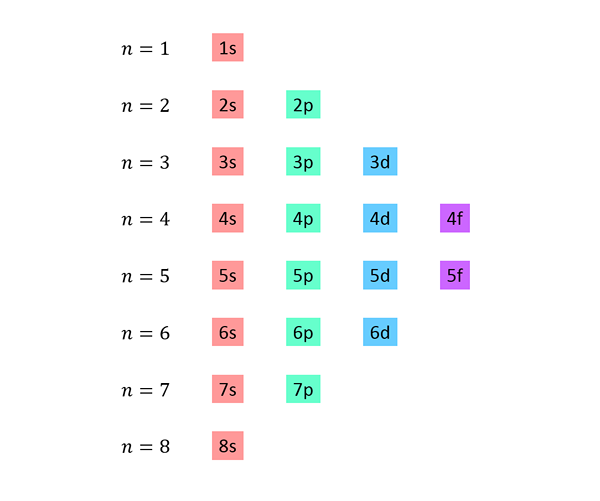
Luettelo, jossa kukin rivi vastaa energiatasoa, ja sisältää yksi toisensa jälkeen, kaikki alatasolla saatavilla olevalla energiatasolla.
Esimerkiksi ensimmäinen rivi vastaa tasoa 1 (n = 1) ja sisältää vain 1S -al -tason; Toinen rivi vastaa tasoa n = 2 ja sisältää 2S- ja 2P -ala -tasot; Kolmas sisältää 3: n, 3P: n ja 3D -alatason ja niin edelleen.
Täydellinen luettelo näyttää tältä:
Vaihe 2
Laskevat diagonaalit vedetään oikealta vasemmalle, yksi alapuolella, kuten alla on esitetty.
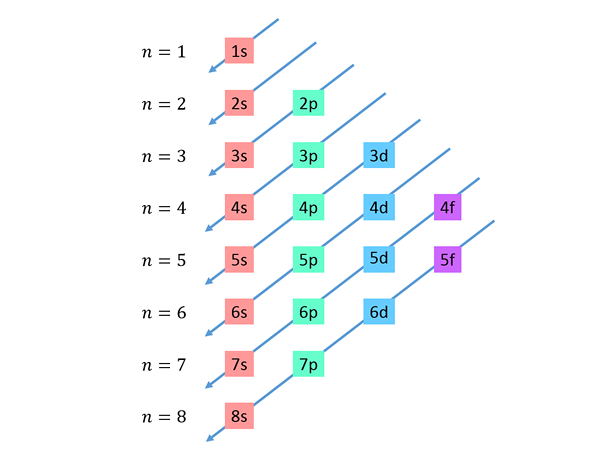
Nämä linjat muistuttavat vesireitiä tuulen aikana tuulen aikana, joten tätä kuvaajaa kutsutaan yleensä "sademenetelmäksi". Täyttömääräys määritetään sen järjestyksen mukaan, jolla nämä diagonaalit koskettavat luettelon alatasoja.
Edellisen luvun perusteella kiertoradan energiajärjestys ja siksi niiden täytettävä järjestys on:
Voi palvella sinua: kvanttitaulukko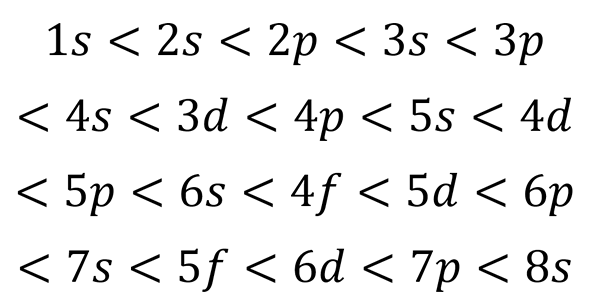
Tämä täyttötilaus on ainoa, jolla todella on merkitystä atomin sähköisen kokoonpanon kirjoittamisessa. Kun täytät näitä alatasoja, on muistettava, että ala -tasoissa s Vain 2 elektronia mahtuu p Astu 6, d -d Ne sopivat 10 ja F Ne sopivat 14.
Poikkeuksia Aufbaun alussa
Aufbaun periaate osoittaa selvästi, että alatasoa ei voida täyttää, ennen kuin kaikki aiemmat alataso on täysin täynnä. Tästä säännöstä on kuitenkin joitain poikkeuksia.
Joissakin tapauksissa atomi mieluummin on, että energiataso on täytetty tarkalleen puoleen kuin epätäydellinen, joka ei ole täynnä puolessa. Näissä tapauksissa atomin todellinen elektroninen kokoonpano ei vastaa ennustettua järjestystä sademenetelmällä.
Esimerkiksi Aufbaun periaatteen mukaan kromiatomilla tulisi olla elektroninen kokoonpano, joka päättyy 4S: hen2 3D4. Sen todellinen kokoonpano on kuitenkin 4S1 3D5 koska siten 4S- ja 3D -alaosa on täytetty puoleen, kun taas toisessa kokoonpanossa ei.
Sama pätee kupariin, jonka kokoonpano päättyy 4s1 3D10, 4 -vuotiaiden sijasta2 3D9, Koska siten täyttää alatason D ja S on täynnä puoleen.
Esimerkkejä Aufbaun periaatteen soveltamisesta
Seuraavaksi on 5 esimerkkiä elementeistä, jotka täyttävät Aufbaun periaate:
Esimerkki 1: Natriumelektroninen kokoonpano
Natrium on elementti 11, joten siinä on 11 protonia ja 11 elektronia. Sen elektroninen kokoonpano on 1s2 2s2 2 p6 3s1.
Esimerkki 2: Argonin elektroninen kokoonpano
Argon (AR) on elementti 18, joten siinä on 18 protonia ja 18 elektronia. Sen elektroninen kokoonpano on siksi 1 s2 2s2 2 p6 3s23P6. Voidaan nähdä, että hänen alaosa- ja P -alatasonsa olivat kokonaan.
Voi palvella sinua: propeenia (C3H6)Esimerkki 3: Elektroninen galliumkokoonpano
Gallium (GA) on elementti 31, joten siinä on 31 protonia ja 31 elektronia. Sen elektroninen kokoonpano on 1s2 2s2 2 p6 3s23P64S23D104P1.
Tämä voidaan kirjoittaa tiivistelmä tavalla, kuten [ar] 4s23D104P1, Jos [AR] edustaa edellisessä esimerkissä esitettyä elektronista argonikokoonpanoa.
Esimerkki 4: Elektroninen hiilen kokoonpano
Hiili (C) on elementti 6, joten siinä on 6 protonia ja 6 elektronia. Sen elektroninen kokoonpano on 1s2 2s2 2 p2.
Esimerkki 5: Elektroninen kloorikokoonpano
Kloori (CL) on elementti 17. Sen 17 elektronia jaetaan seuraavan elektronisen kokoonpanon mukaisesti: 1s2 2s2 2 p6 3s23P5 tai [ne] 3s23P5.
Lisäesimerkkejä poikkeuksista Aufbaun alussa
Seuraavaksi on 2 lisäesimerkkiä elementeistä, jotka rikkovat Aufbaun periaatetta:
Esimerkki 6: Molybdeenin elektroninen kokoonpano
Molybdeeni (MO) on elementti 42. Ensimmäiset 36 elektronia jaetaan samalla tavalla kuin kryptonissa, mutta sen valenssielektronit eivät noudata normaalia järjestystä. Sen sijaan, että se olisi sähköinen kokoonpano [KR] 5s24D4, Sen kokoonpano on [KR] 5s14D5, Samanlainen kuin mitä Chromen kanssa tapahtuu.
Esimerkki 7: Hopea sähköinen kokoonpano
La Plata (AG, elementti 47) esittelee Aufbaun periaatetta, joka on samanlainen kuin kuparin periaatteella. Sen elektroninen kokoonpano on [KR] 5s14D10 [KR] 5: n sijasta24D9.

