Perussuolojen kaava, ominaisuudet, nimikkeistö, esimerkit

- 1532
- 189
- Alonzo Kirlin
Se perussuolat Ne ovat kaikki ne, jotka liukenevat veteen, tuottavat liuoksia, joiden pH -arvot ovat yli 7. Tämä selitetään OH -ionin muodostumisella-, jotka tulevat suoraan liukenemisprosessista tai hydrolyysitasapainosta, missä anionia osallistuu.
Perussuolat sisältävät anionin OH- Kiintoaineissaan. Esimerkiksi alkali hydroksidit, kuten natrium ja kalium, NaOH ja KOH, pidetään näiden suolojen jäseninä; Vaikka ne ovat erittäin kaustisia, minkä vuoksi he ansaitsevat hydroksidien uskonnon sen sijaan, että niitä kutsutaan suoliksi.
 Natriumhydroksidi on esimerkki emäksisestä suolasta
Natriumhydroksidi on esimerkki emäksisestä suolasta Muilla perussuoloilla on sen sijaan anionit, kuten karbonaatti, CO32-. Karbonaatti on peräisin hiilihapoista, H2Yhteistyö3, Heikko happo. Siksi karbonaattisuolat, kuten antasideissa käytetty kalsiumkarbonaatti, luokitellaan perussuoloiksi. Sama päättely koskee natriumbikarbonaattia, Nahco3, Ja kaikille muille bikarbonaattisuoloille.
Perussuolat ovat tärkeitä, koska monet niistä auttavat neutraloimaan ruoan happamuutta. Niitä voidaan käyttää myös vaimennusliuosten valmistamiseen emäksiseen pH: lle.
[TOC]
Määritelmät
Perussuoloilla on kaksi määritelmää, jotka täydentävät toisiaan: ne sisältävät OH -anionit- Niiden kiintoaineidensa aikana tai tuottavat nämä samat hydroksilli -anionit, kun niiden kiteet liukenevat veteen.
Riippumatta valitusta määritelmästä.
Perussuolojen yleinen kaava
Selvensi, mitä perussuola ymmärretään, sen kaava, vaikkakaan ei tiukasti yleinen, on seuraava:
Mn(VAI NIIN)W -XOv
Missä m on metallinen tai ammoniumkaatio, OH hydroksiilit ja XO anionista, joka on johdettu heikoista tai vahvasta happosta. Tilaukset n, W - ja v Kuinka monta m, OH ja XO muodostavat perussuolan ja niiden mittasuhteet.
Ota huomioon, että v Se voi olla yhtä suuri kuin nolla, mikä tarkoittaa, että meillä on emäksinen tai alkalinoterreo -hydroksidi. Näin tapahtuu NaOH: n ja KOH: n kanssa. Samoin, W - Se voi olla nolla, mikä tarkoittaa, että ioneja ei ole OH-. Esimerkiksi Caco3 Sillä ei ole OH-, Ja silti se on perussuola.
Voi palvella sinua: kalsiumsulfidi (CAS): rakenne, ominaisuudet, hankkiminen, käyttöYllä olevasta on päätelty, että perussuolojen yleinen kaava on Mn(VAI NIIN)W -XOv, Mutta kaikki suolat eivät ole tämän mukaisia. Siksi tärkeämpi tekijä, joka on otettava huomioon, on XO -anionin luonne. Siten se tiedetään, kun suola on emäksinen riippumatta siitä, onko sillä ioneja OH vai ei- Heidän kaavoissaan.
Perussuolan ominaisuudet
Perussuolat liukenevat veteen seuraavan yhtälön jälkeen:
Mn(VAI NIIN)W -XOv(s) → nM+(AC) + W -vai niin-(AC) + vXO-(AC)
Huomaa, että kun se liukenee, vapauttaa OH -ionit- vedessä. Tämä vaikuttaa liuoksen pH: hon, josta tulee alkali, jonka arvo on yli 7. Esimerkiksi kalsiumnitraatti liukenee veteen sen seuraavan mukaan:
CA (OH) Ei3(S) → CA2+(AC) + OH-(ac) + ei3-(AC)
Arvot n, W - ja v Ne ovat yhtä suuret kuin tämä suola.
Toisaalta perussuolat, joilla ei ole OH-, Mutta heikoista haposta johdettu anioni hydrolysoidaan veteen:
Varas3(S) → CA2+(AC) + Co32-(AC)
Yhteistyö32-(AC) + H2Tai (l) ⇌ HCO3-(AC) + OH-(AC)
Huomaa, että tämän hydrolyysin tuote on OH -anioni-. Sieltä on näiden emästen emäksisyys. Ja kuten odotettiin, ne ovat kuitenkin vähemmän perustiedot kuin ne, joilla on jo ionit OH- läsnä heidän kiteissä. Esimerkiksi NaOH on erittäin yksinkertainen:
NaOH (s) → NA+(AC) + OH-(AC)
No, vapauta OH -ionit- Suoraan heti, kun vesi koskettaa; Tai mikä pahempaa, tuskin koskettaa ihon kosteutta.
Voi palvella sinua: Carbocation: muodostuminen, ominaisuudet, tyypit, stabiilisuusMuut perussuolojen fysikaaliset tai kemialliset ominaisuudet eivät eroa liikaa muiden neutraalien tai happosuolojen ominaisuuksista.
Nimikkeistö
Perussuolojen nimikkeistö riippuu anionin XO: n luonteesta: jos se on monoatomia, tai jos se on oksoanioni. Tässä osiossa keskitytään kuitenkin erityisesti perussuoloihin, joissa on OH -anionit-. Niillä, joilla ei ole niitä, on paljon helpompia nimikkeitä muistettavaksi tai syytä.
Monoatomisilla anionilla
Monoatomisianionit eivät ole esitetty XO: ksi, vaan x. Ne johdetaan HX -hydraseidista, kuten fluoridihappo, HF tai suolahappo, HCl ja niin edelleen.
Näissä tapauksissa ne nimetään systemaattisesti kahdella tavalla:
(Numeraalinen etuliite paitsi apinaa) Hydroxi + Anion -nimi, joka päättyy metallin jälkiliitteellä -RO + sen valenssilla suluissa (jos siinä on enemmän kuin yksi)
Esimerkiksi Salt Ni (OH) Cl kutsutaan nikkelihydroksikloridiksi (II).
Anionimi, jonka päättyminen -RO + -(Numeraalinen etuliite paitsi apina) Hydroksidi + metalli -nimi ja sen valenssi suluissa
Esimerkiksi Salt Ni (OH) CL voidaan myös nimetä nikkelikloridi-hydroksidiksi (II).
Meillä on myös perinteinen nimikkeistö, joskus sekoitettu systemaattisiin:
Anionimi, jota seuraa (numeraalinen etuliite paitsi apina) perustiedot ja metallin nimi jälkiliitteillä -ooso tai -con kanssa sovellettuna.
Esimerkiksi Ni (OH) CL: tä kutsutaan nikkeli -emäksiskloridiksi tai emäksiseksi nikkelikloridiksi (II).
Oksoanioilla
Systemaattinen nimikkeistö perussuoloille, joissa on oksoanioita. Yksinkertaisin versio on kuitenkin rakennettu seuraavasti:
(Numeraalinen etuliite) Hydroksidi- (anionimi) + + metallin nimestä ja sen valencia suluissa
Esimerkiksi usko (OH) ei3 kutsutaan: hydroksidi-rauta-nitraatti (II).
Sillä on myös perinteinen nimikkeistö:
Perus Nion + (Numeraalinen etuliite) Nimi + metallin nimi päättyy -oso tai -ico
Voi palvella sinua: happi: ominaisuudet, rakenne, riskit, käyttötarkoituksetSiten usko (oH) ei3 Sitä kutsutaan: rauta -perusnitraatti tai rauta -nitraatti (II).
Koulutus
Perussuolat ovat happo-emäs neutralaatioiden tuote, erityisesti hydraation tai oksoaasidin välillä, joissa on ylimääräinen emäs tai hydroksidi:
Emäs (ylimääräinen) + happo → emäksinen suola tai alkalinen + vesi
Esimerkiksi ca (OH) ei3 Se muodostuu neutraloimalla typpihappo ylimääräisellä kalsiumhydroksidilla:
CA (OH)2(Ylimääräinen) + hno3 → CA (OH) EI3 + H2JOMPIKUMPI
Toinen koulutuksen muodostuminen olisi seuraava:
Usko (Voi)3(Ylimääräinen) + h2Sw4 → Fe (OH) niin4 + 2H2JOMPIKUMPI
Tätä suolaa kutsutaan: emäksinen ferrisulfaatti, emäksinen rautasulfaatti (III) tai rautahydroksidisulfaatti (III).
Esimerkkejä perussuoloista
 Antasidit, kuten kalsiumkarbonaatti, Caco3, ovat esimerkkejä perussuoloista. Lähde: Pixabay.
Antasidit, kuten kalsiumkarbonaatti, Caco3, ovat esimerkkejä perussuoloista. Lähde: Pixabay. Lopuksi, joitain muita esimerkkejä perussuoloista luetellaan heidän yksinkertaisempien nimiensä kanssa:
-Nach3COO: Natriumasetaatti
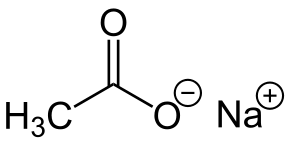 Natriumasetaattia
Natriumasetaattia -Naa2S: Natriumsulfidi
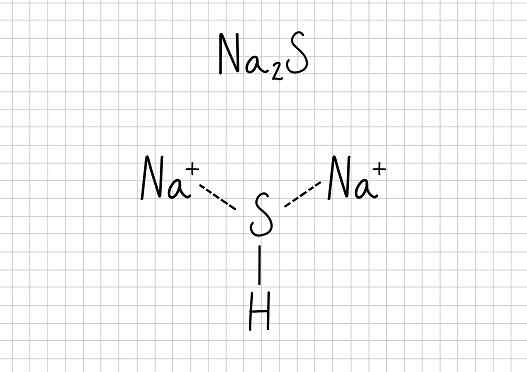 Natriumsulfidi
Natriumsulfidi -KCN: Kaliumsyanidi
-Mgco3: magnesiumkarbonaatti
-Usko (oi) niin3: Perusrautasulfiitti (III)
-Usko (oH) (c6H5Kujertaa)2: Perusrautabentsoaatti (III)
-AUCL (OH)2: Kultainen dibasinen kloridi (III)
-Cuclo3(Voi): Peruskupari kloraatti (II)
-At (oH) niin4: Alumiinisulfaatti
-PB (OH)2Yhteistyö3: Dibasinen lyijykarbonaatti (IV)
Perussuolojen ongelmana on, että kaikkia niitä ei voida valmistaa, koska ylimääräinen pohja tai hydroksidi ei riitä kiteyttämään niitä turvautumatta muihin prosesseihin. Näin on PB (OH)2Yhteistyö3. Tämä karbonaatti on kuitenkin olemassa valkoisena lyijyn (II) pigmenttinä, jonka kaava on 2PBCO3· PB (OH)2 tai pb3(VAI NIIN)2(Yhteistyö3-A2.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Alkalisuola. Haettu: vuonna.Wikipedia.org
- Wu c., Dowell C. & Hooper n. (1. heinäkuuta 2014). Suolojen happo-emäsominaisuudet. Palautettu: Chem.Librettexts.org
- Nicola McDougal. (2020). Happamat ja emäksiset suolaliuokset: Selitys ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- Ongelma- ja kemialliset harjoitukset. (S.F.-A. Perussuolat. Toipunut.On
- « Konsepti ja esimerkit materiaalirakenne
- Porrastetut funktioominaisuudet, esimerkit, harjoitukset »

