Termodynamiikan kaavojen toinen laki, yhtälöt, esimerkit

- 1937
- 328
- Alonzo Kirlin
Se Termodynamiikan toinen laki on useita ilmaisumuotoja. Yksi heistä toteaa, että mikään lämpökone ei kykene muuttamaan kokonaan kaikki energiat, jotka se imee käyttökelpoiseksi työksi (Kelvin-Planck Formulation). Toinen tapa todeta, että on sanoa, että todelliset prosessit tapahtuvat siten, että energian laatu on alhaisempi, koska Haje Sillä on taipumus kasvaa.
Tämä laki, joka tunnetaan myös nimellä termodynamiikan toinen periaate, on ilmaistu eri tavoin ajan kuluessa 1800 -luvun alusta nykypäivään, vaikka sen alkuperät ovat peräisin ensimmäisten höyrykoneiden luomisesta Englannissa, Englannissa, 1800 -luvun alussa.
 Kuvio 1. Kun rakennetaan rakennuspalikoita lattialle, olisi erittäin yllättävää pudota tilaamasta. Lähde: Pixabay.
Kuvio 1. Kun rakennetaan rakennuspalikoita lattialle, olisi erittäin yllättävää pudota tilaamasta. Lähde: Pixabay. Mutta vaikka se ilmaistaan monin tavoin, kaikessa ajatuksessa, jolla on taipumus häiriöihin ja että ei ole 100%: n prosessia, koska tappioita on aina olemassa.
Kaikki termodynaamiset järjestelmät tarttuvat tähän periaatteeseen, alkaen itse maailmankaikkeudesta aamukahvin kuppiin, jotka odottavat hiljaa pöydällä vaihtamalla lämpöä ympäristön kanssa.
Kahvi jäähtyy ajan kuluessa, kunnes se on ympäristön lämpötasapainossa, joten olisi erittäin yllättävää, jos jonain päivänä päinvastoin tapahtuisi ja ilmapiiri jäähtyy, kun kahvi kuumenee itselleen. Se ei todennäköisesti tapahdu, jotkut sanovat sen mahdottomaksi, mutta riittää kuvitella, että se olisi käsitys siitä, missä asiat tapahtuvat spontaanisti.
Toisessa esimerkissä, jos liu'utamme kirjan pöydän pinnalle, se lopulta pysähtyy, koska sen kineettinen energia menetetään kitkan takia lämpöä.
Termodynamiikan ensimmäinen ja toinen laki perustettiin noin vuonna 1850, kiitos termin "termodynamiikka" -Lord Kelvinin kaltaisille tutkijoille -William Rankine -Termodynamiikan ensimmäisen muodollisen tekstin -ja Rudolph Clausius.
[TOC]
Kaavat ja yhtälöt
Entropia -vähemmän kuin alku -pyrkii meihin luomaan sen merkityksen, jossa asiat tapahtuvat. Palataan takaisin esimerkkiin lämpökontaktissa olevista rungoista.
Kun kaksi objektia eri lämpötiloissa asetetaan kosketukseen ja lopulta hetken kuluttua ne saavuttavat lämpötasapainon, ne ajavat siihen sillä, että entropia saavuttaa maksiminsa, kun molempien lämpötila on sama, sama on sama.
Merkitsee entropiaa nimellä S, Entropian muutos ΔS järjestelmän annetaan:

Entropian muutos ΔS Se osoittaa järjestelmän häiriön asteen, mutta tämän yhtälön käytössä on rajoitus: se soveltuu vain palautuviin prosesseihin, ts. Ne, joissa järjestelmä voi palata alkuperäiseen tilaansa jättämättä merkkiä siitä, mitä mitä tapahtui-.
Peruuttamattomissa prosesseissa termodynamiikan toinen laki ilmenee seuraavasti:
Voi palvella sinua: Reynolds Number: Mihin se on, miten se lasketaan, harjoitukset
Palautuvat ja peruuttamattomat prosessit
Kahvikuppi jäähtyy aina ja on hyvä esimerkki peruuttamattomasta prosessista, koska se tapahtuu aina yhteen suuntaan. Jos kermaa lisätään kahviin ja sekoita, saadaan erittäin miellyttävä yhdistelmä, mutta riippumatta siitä, kuinka sekoittuu uudelleen, kahvi ja kerma eivät ole enää, koska sekoittaminen on peruuttamatonta.
 Kuva 2. Kupin rikkoutuminen on peruuttamaton prosessi. Lähde: Pixabay.
Kuva 2. Kupin rikkoutuminen on peruuttamaton prosessi. Lähde: Pixabay. Vaikka suurin osa päivittäisistä prosesseista on peruuttamattomia, jotkut ovat melkein Palautuva. Palautuvuus on idealisointi. Suoritettavaksi järjestelmän on vaihdettava hyvin hitaasti, niin että jokaisessa vaiheessa se on aina tasapainossa. Tällä tavoin on mahdollista palauttaa se edelliseen valtioon jättämättä jälkiä ympärille.
Prosessit, jotka ovat melko lähellä tätä ideaalia.
Kitkajoukko on vastuussa suuresta osasta peruuttamattomuutta, koska sen tuottama lämpö ei ole etsitty energiatyyppi. Pöydän yli liu'uttaessa kirjaa kitkalla on energiaa, jota ei ole otettu talteen.
Vaikka kirja palaa alkuperäiseen sijaintiinsa, pöytä on ollut kuuma kuin tulevan jalanjälki ja sen jatkaminen.
Tarkkaile nyt hehkulamppuja: suurin osa filamentin ylittävän virran tekemästä työstä tuhlaa kuumuudessa Joule -efektillä. Vain pieni prosenttiosuus käytetään valoa lähettämiseen. Molemmissa prosesseissa (kirja ja polttimo) järjestelmän entropia on lisääntynyt.
Sovellukset
Ihanteellinen moottori on se, joka on rakennettu palautuvien prosessien kautta ja josta puuttuu kitka, joka aiheuttaa energiajätteitä, kääntämällä melkein Kaikki lämpöenergiaa käyttökelpoisessa työssä.
Korostamme sanaa melkein, koska edes ihanteellisella moottorilla, joka on Carnotin, ei ole 100% tehokkuutta. Termodynamiikan toinen laki ei ole tällä tavalla.
Karnot -moottori
Carnotin moottori on tehokkain moottori, joka voidaan suunnitella. Se toimii kahden lämpötilakerroksen välillä kahdessa isotermisessä prosessissa - vakiona lämpötilassa - ja kahdessa adiabaattisessa prosessissa - ilman lämpöenergiansiirtoa-.
Kaaviot, joita kutsutaan PV -painekaavioiksi - tilavuus - selventävät tilannetta:
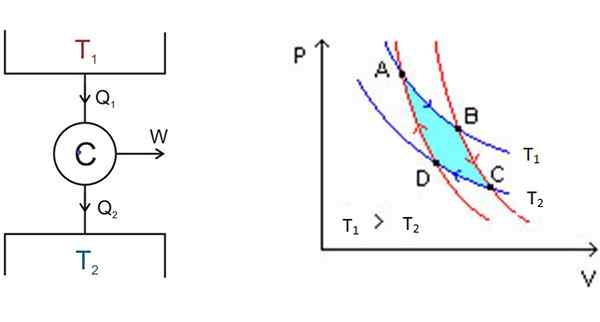 Kuva 3. Vasemmalla puolella Carnot-moottorijärjestelmä ja oikealle P-V-kaavio. Lähde: Wikimedia Commons.
Kuva 3. Vasemmalla puolella Carnot-moottorijärjestelmä ja oikealle P-V-kaavio. Lähde: Wikimedia Commons. Vasemmalla kuviossa 3 on Carnot C -moottorin kaavio, joka vie lämpöä Q1 talletuksesta lämpötilassa t1, Muunna tämä lämpö työksi w ja anna sen jätettä2 kylmimpaan talletukseen, joka on lämpötilassa t2.
Alkaen A1. B: ssä järjestelmä aloittaa adiabaattisen laajennuksen, jossa lämpöä ei voiteta tai kadota, päästäksesi C: hen.
CL: ssä alkaa toinen isoterminen prosessi: antaa lämpöä toiselle kylmemmälle lämpövarastolle, joka on T: ssä2. Kuten tämä tapahtuu, järjestelmä on pakattu ja kohta D saavutetaan. Siellä alkaa toinen adiabaattinen prosessi palata lähtöpisteeseen. Tällä tavoin sykli on valmis.
Se voi palvella sinua: lämmönsiirto ajamalla (esimerkkien kanssa)Carnotin tehokkuus riippuu Kelvinin lämpötiloista kahdessa lämpökerroksessa:
Suurin hyötysuhde = (QSisäänkäynti - Q -poistuminen) /QSisäänkäynti = 1 - (t2/T1-A
Carnotin lause toteaa, että tämä on tehokkain lämpökone, mutta älä kiirehdi ostamaan sitä. Muistatko, mitä sanoimme prosessien palautuvuudesta? Niiden on tapahduttava hyvin, hyvin hitaasti, joten tämän koneen lähtöteho on käytännössä nolla.
Ihmisen aineenvaihdunta
Ihmiset tarvitsevat energiaa kaikkien järjestelmänsä pitämiseksi toimivia, siksi ne käyttäytyvät lämpökoneina, jotka saavat energiaa ja muuttavat sen mekaaniseksi energiaksi esimerkiksi liikkumaan.
Tehokkuus ja ihmiskehosta, kun teet työtä, voidaan määritellä sen tarjoaman mekaanisen voiman ja ruuan mukana tulevan kokonaisenergian pääsyn väliseksi suhde.
Kuten keskimääräinen voima pm Se on W -työ, joka tehdään aikavälillä Δt, Se voidaan ilmaista seuraavasti:
Pm = W/Δt
Joo ΔU/Δt Se on nopeus, johon energiaa lisätään, kehon tehokkuus pysyy:

Lukuisten vapaaehtoisten testien avulla on saatu jopa 17 prosentin tehokkuutta, mikä tuottaa noin 100 wattia tehoa useita tunteja.
Tietenkin tämä riippuu suurelta osin suoritetusta tehtävästä. Polkupyörän polkinnassa on hiukan suurempi tehokkuus, noin 19 %, kun taas toistuvien tehtävien, jotka sisältävät terät, piikit ja kuokat, on niin alhainen tehokkuus kuin noin 3 %.
Esimerkit
Termodynamiikan toinen laki on implisiittinen kaikissa maailmankaikkeudessa tapahtuvissa prosesseissa. Entropia kasvaa aina, vaikkakin joissakin järjestelmissä se näyttää vähenevän. Jotta tämä on lisääntynyt muualla, niin että kokonaismäärässä se on positiivinen.
- Oppimisessa on entropiaa. On ihmisiä, jotka oppivat asiat hyvin ja nopeasti, sen lisäksi, että pystyvät muistamaan ne helposti. Sanotaan, että he ovat ihmisiä, joilla on alhainen entropia -oppiminen, mutta he ovat varmasti vähemmän kuin korkean entropian ihmiset: ne, jotka ovat eniten muistettavia asioita.
- Yrityksellä, jolla on epäorgaanisia työntekijöitä. On selvää, että jälkimmäinen on tehokkaampi kuin ensimmäinen.
- Kitkavoimat tuottavat vähemmän tehokkuutta koneiden toiminnassa, koska ne lisäävät hajotetun energian määrää, jota ei voida käyttää tehokkaasti.
- Noppan käynnistämisellä on suurempi entropia kuin kolikon heittäminen ilmaan. Loppujen lopuksi valuutan käynnistämisellä on vain 2 mahdollista tulosta, kun taas noppan käynnistäminen on 6. Mitä enemmän tapahtumia on todennäköistä, sitä enemmän entropiaa on olemassa.
Voi palvella sinua: mitkä ovat liikkeen elementit?Ratkaisut
Harjoitus 1
Männän sylinteri täytetään neste- ja vesihöyryn seoksella 300 K: n lämpötilassa ja 750 kJ lämpöä siirretään vakiopaineprosessiin. Seurauksena on, että sylinterin sisällä oleva neste höyrystyy. Laske entropian muutos prosessissa.
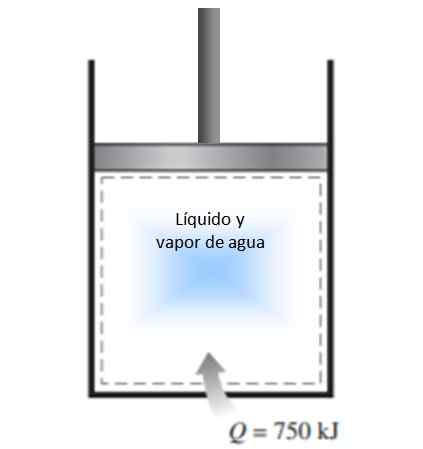 Kuva 4. Esimerkin ratkaisu 1. Lähde: f. Zapata.
Kuva 4. Esimerkin ratkaisu 1. Lähde: f. Zapata. Ratkaisu
Lausunnossa kuvattu prosessi suoritetaan vakiopaineessa suljetussa järjestelmässä, joka ei koe massanvaihtoa.
Koska se on höyrystyminen, jonka aikana lämpötila ei muutu (vaihemuutosten aikana lämpötila on vakio), edellä annetun entropian muutoksen määritelmää voidaan käyttää ja lämpötila voi jättää pois integraalista:

ΔS = 750.000 J / 300 K = 2500 J / K.
Koska järjestelmä tulee järjestelmään, entropian muutos on positiivinen.
Harjoitus 2
Kaasu kärsii paineen noususta 2.00 - 6.00 ilmakehää (ATM), ylläpitää vakiotilavuutta 1.00 m3, ja laajenna sitten vakiopaineessa, kunnes se saavuttaa 3: n tilavuuden.00 m3. Lopuksi palaa alkuperäiseen tilaansa. Laske kuinka paljon työtä suoritetaan yhdessä syklissä.
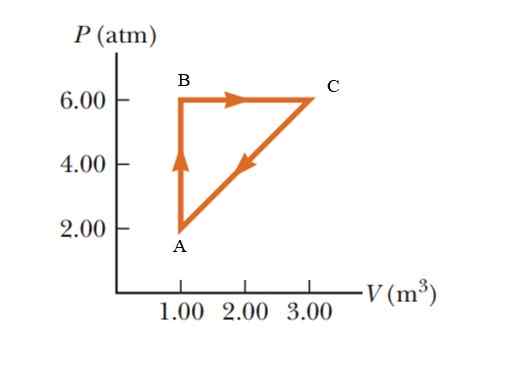 Kuva 5. Termodynaaminen prosessi esimerkiksi 2 kaasussa 2. Lähde: Serway -Velle. Fysiikan perusteet.
Kuva 5. Termodynaaminen prosessi esimerkiksi 2 kaasussa 2. Lähde: Serway -Velle. Fysiikan perusteet. Ratkaisu
Se on syklinen prosessi, jossa sisäinen energian vaihtelu on tyhjä, termodynamiikan ensimmäisen lain mukaan q = w. P -V -kaaviossa (paine - tilavuus) syklisen prosessin aikana tehty työ vastaa käyrän lukitsemaa aluetta. Tulosten antamiseksi kansainvälisessä järjestelmässä on välttämätöntä muuttaa yksiköitä paineessa seuraavan muuntokertoimen kautta:
1 ATM = 101.325 kPa = 101.325 PA.
Kaavion sulkeminen alue vastaa kolmiota, jonka pohja (3 - 1 m3) = 2 m3 ja jonka korkeus on (6 - 2 atm) = 4 atm = 405.300 Pa
W -Abca = ½ (2 m3 x 405300 pa) = 405300 J = 405.3 kJ.
Harjoitus 3
Sanotaan.
Laske: a) teoreettinen tehokkuus, b) koneen toimittama mekaaninen teho, jos absorboitiin 1.40 x 105 J Energian joka sekunti kuumasta säiliöstä. On tiedossa, että todellinen tehokkuus on 42.0%.
Ratkaisu
a) Suurin hyötysuhde lasketaan yllä annetulla yhtälöllä:
Suurin hyötysuhde = (QSisäänkäynti - Q - poistuminen) /QSisäänkäynti = 1 - (t2/T1-A
Celsiuksen siirtämiseksi Kelviniin riittää lisäämään 273.15 Celsiuksen lämpötilassa:
Kertomalla 100%: lla, sinulla on maksimaalinen prosenttiosuus, mikä on 67.2%
c) Jos todellinen tehokkuus on 42%, on maksimitehokkuus 0.42.
Toimitettu mekaaninen teho on: p = 0.42 x 1.40 x10 5 J/s = 58800 W.
Viitteet
- Bauer, W. 2011. Fysiikka tekniikkaan ja tieteisiin. Osa 1. MC Graw Hill.
- Cengel, ja. 2012. Termodynamiikka. 7mehu Painos. McGraw Hill.
- Figueroa, D. (2005). Sarja: Tieteen ja tekniikan fysiikka. Osa 4. Nesteet ja termodynamiikka. Toimittanut Douglas Figueroa (USB).
- Ritari, r. 2017. Tutkijoiden fysiikka ja tekniikka: strategialähestymistapa.
- López, c. Termodynamiikan ensimmäinen laki. Toipunut: Culturacientifica.com.
- Serway, R. 2011. Fysiikan perusteet. 9naa Cengage -oppiminen.
- Sevillan yliopisto. Lämpökoneet. Toipunut: Laplace.meille.On
- « Asianajajan teorian periaatteet, ajanjaksot ja mallit
- Valtion tyyppien ja niiden ominaisuuksien muutokset (esimerkkien kanssa) »


=0.672)