Valtion tyyppien ja niiden ominaisuuksien muutokset (esimerkkien kanssa)
- 3511
- 1030
- Dr. Travis Reichert
Se valtion muutokset tai vaihe ovat termodynaaminen ilmiö, jossa aineskokemukset palautuvat fyysiset muutokset. Sanotaan, että se on termodynaaminen, koska lämmönsiirto tapahtuu aineen ja ympäristön välillä; Tai mikä on sama, aineen ja energian välillä on vuorovaikutusta, joka indusoi hiukkasten uudelleenjärjestelyn.
Tilanmuutoksen koevat hiukkaset pysyvät samana ennen ja jälkeen. Paine ja lämpötila ovat tärkeitä muuttujia siinä, kuinka nämä sijoitetaan yhdessä tai toisessa vaiheessa. Kun tilanmuutos tapahtuu, muodostuu kaksifaasinen järjestelmä, joka koostuu samasta asiasta kahdessa eri fyysisessä tilassa.
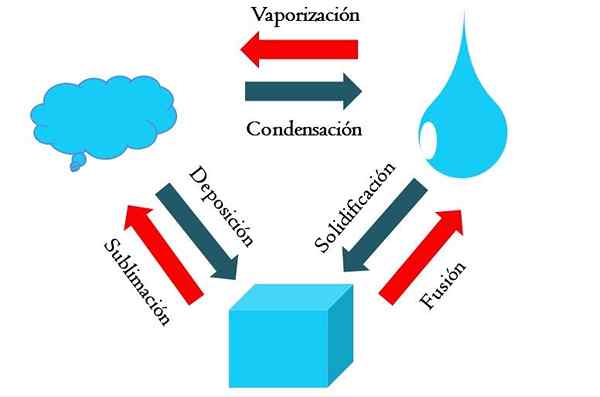
 Valtion muutokset. Lähde: Gabriel Bolívar
Valtion muutokset. Lähde: Gabriel Bolívar Korkeampi kuva näyttää tilan tärkeimmät muutokset, jotka ovat tärkeitä kokemuksia normaaleissa olosuhteissa.
Sinertävän aineen kiinteästä kuutiosta voi tulla nestemäinen tai kaasuma sen ympäristön lämpötilasta ja paineesta riippuen. Sinänsä se edustaa yksivaiheista: kiinteä. Mutta sulamishetkellä, toisin sanoen sulaa, kiinteän nesteen tasapaino, jota kutsutaan fuusioksi (punainen nuoli kauhan ja sinisen pudotuksen välillä on muodostettu).
Fuusion aikaansaamiseksi kuution on absorboitava lämpö ympäristöstä sen lämpötilan nostamiseksi; Siksi se on endoterminen prosessi. Kun kuutio on sulaa, se on jälleen yksivaihe: nestemäinen tila.
Tämä blota voi edelleen absorboida lämpöä, mikä nostaa lämpötilansa ja aiheuttaa kaasumaisten kuplien muodostumisen. Jälleen on kaksi vaihetta: yksi neste ja toinen sooda. Kun kaikki neste on haihtunut kiehumispisteensä läpi, sanotaan sitten, että se on keitetty tai höyrystynyt.
Nyt sinertävät tipat muutettiin pilviksi. Toistaiseksi kaikki prosessit ovat olleet endotermisiä. Sinertävä kaasu voi jatkaa lämpöä, kunnes se lämmitetään; Maa -olosuhteiden vuoksi tämä päinvastoin pyrkii jäähtymään ja tiivistämään jälleen nesteessä (kondensaatio).
Toisaalta pilvet voidaan myös tallettaa suoraan kiinteään faasiin muodostaen kiinteän kuution uudelleen (laskeuma). Nämä kaksi viimeistä prosessia ovat eksotermisiä (siniset nuolet); eli ne vapauttavat lämpöä ympäristöön tai ympärille.
Kondensaation ja laskeutumisen lisäksi tilan muutos tapahtuu, kun blota jäätyy matalissa lämpötiloissa (jähmettyminen).
[TOC]
Valtion muutokset ja niiden ominaisuudet
Kuva näyttää tyypilliset muutokset kolmelle (yle. Punaiset nuolet seuraavat muutokset ovat endotermisiä, ne merkitsevät lämmön imeytymistä; Kun taas siniset nuolet ovat eksotermisiä.
Alla tehdään lyhyt kuvaus jokaisesta näistä muutoksista, mikä korostaa joitain sen ominaisuuksia molekyylin ja termodynaamisen päättelyn perusteella.
- Fuusio
Fuusio on aineen tilan muutos kiinteästä tilasta nesteeseen.

Kiinteässä tilassa hiukkaset (ionit, molekyylit, klusterit jne.) ovat ”vankeja”, jotka sijaitsevat kiinteissä avaruusasennoissa kykenemättä liikkumaan vapaasti. Ne kykenevät kuitenkin värähtelemään eri taajuuksilla, ja jos nämä ovat erittäin vahvoja, molekyylien välisten voimien asettama tiukka järjestys alkaa "murentua.
Seurauksena on, että saadaan kaksi vaihetta: yksi, jossa hiukkaset jatkavat rajoittuneita (kiinteitä), ja toinen, missä ne ovat vapaampia (neste), riittävät lisäämään etäisyyksiä, jotka erottavat ne toisistaan. Tämän saavuttamiseksi kiinteän aineen on absorboida lämpö, ja siten sen hiukkaset värähtelevät suuremmalla voimalla.
Se voi palvella sinua: Atomi -massa: Määritelmä, tyypit, kuinka laskea, esimerkkejäTästä syystä fuusio on endoterminen, ja kun se alkaa.
Tämän muutoksen aikaansaamiseksi tarvittavaa lämpöä kutsutaan lämmön tai sulamisen entalpiaksi (ΔHFus-A. Tämä ilmaisee lämmön määrän (energia, pääasiassa KJ -yksiköissä), jonka on absorboida mooli kiinteän tilan aineen sulamiseksi ja joka ei vain nosta sen lämpötilaa.
Lumipallo
 Sulaneen lumi kädellä. Lähde: Pixabay
Sulaneen lumi kädellä. Lähde: Pixabay Tätä silmällä pitäen ymmärretään, miksi lumipallo sulaa kädessä (ylivoimainen kuva). Lumi imee kehon lämpöä, mikä riittää nostamaan lumen lämpötilaa yli 0 ° C.
Lumissa olevat jääkiteet absorboivat oikean lämmön sulaa ja niin, että niiden vesimolekyylit ottavat häiriöllisemmän rakenteen. Vaikka lumi sulaa, muodostettu vesi ei nosta lämpötilaansa, koska kaikki käden lämpö hyödyntää lunta fuusion loppuun saattamiseksi.
- Höyrystyminen

Höyrystys on aineen tilan muutos nestemäisestä tilasta kaasumaiseksi.
Jatkamalla veden esimerkkiä, asettamalla nyt kourallinen lunta pottiin ja sytyttäen tulen, havaitaan, että lumi sulaa nopeasti. Kun vettä lämmitetään, pienet hiilidioksidikuplat ja muut mahdolliset kaasu epäpuhtaudet alkavat muodostua.
 Kiehuvaa vettä. Lähde: Pixabay
Kiehuvaa vettä. Lähde: Pixabay Lämpö laajentunut molekyylisesti veden epäjärjestykselliset kokoonpanot, laajentaen sen tilavuutta ja lisäämällä sen höyrynpainetta; Siksi on useita molekyylejä, jotka pakenevat kasvavan haihtumisen pintatuotteesta.
Nestemäinen vesi nostaa lämpötilaansa hitaasti, koska se on korkea spesifinen lämpö (4184 j/° C ∙ g) g). On piste, jossa lämpö, joka absorboi, ei enää käytä sitä lämpötilan nostamiseen, vaan nestemäisen höyryn tasapainon aloittamiseen; Eli se alkaa kiehua ja kaikki neste kulkee kaasumaiseen tilaan absorboivan lämpöä ja pitää lämpötilan vakiona.
Tässä havaitaan voimakas kupla keitetyn veden pinnalla (ylivoimainen kuva). Lämpöä, joka absorboi nestemäistä vettä siten, että sen alkavan kuplien höyrynpaine on yhtä suuri kuin ulkoinen paine, kutsutaan höyrystys entalpiaksi (ΔHHöyry-A.
Paineen rooli
Paine on myös ratkaiseva valtion muutoksissa. Mikä on sen vaikutus höyrystymiseen? Että suuremmassa paineessa, mitä suurempi lämpö on absorboitava vesi kiehua, ja siksi se höyrystyy yli 100 ° C.
Tämä johtuu siitä, että paineen nousu vaikeuttaa paeta vesimolekyyleistä nestefaasista soodaan.
Paine ruukut käyttävät tätä tosiasiaa niiden eduksi lämmittää ruokaa vedessä lämpötilassa niiden kiehumispisteen yläpuolella.
Toisaalta tyhjiö tai paineen väheneminen, nestemäinen vesi tarvitsee alhaisemman lämpötilan kiehua ja siirtyä kaasufaasiin. Paljon tai pienellä paineella, veden keittämishetkellä veden on absorboitava sen vastaava höyrystymislämpötilan muutoksen loppuunsaattamiseksi.
- Tiivistyminen
Kondensaatio on aineen tilan muutos kaasumaisesta tilasta nestemäiseen tilaan.
Voi palvella sinua: galaktoosi
Vesi on höyrystynyt. Mitä seuraavaksi? Vesihöyry voi silti nostaa lämpötilaansa, ja siitä tulee vaarallinen virta, joka pystyy aiheuttamaan vakavia palovammoja.
Sen sijaan oletetaan kuitenkin, että se jäähtyy. Kuten? Lämmön vapauttaminen ympäristöön, ja kun se vapautetaan lämpöä, sanotaan, että eksoterminen prosessi tapahtuu.
Vapauttamalla lämmön, hyvin energiakaasumaiset molekyylit alkavat hidastua. Lisäksi sen vuorovaikutukset alkavat olla tehokkaampia höyryn lämpötilan laskeutuessa. Ensinnäkin vesipisarat, höyrykondensaatti, jota seuraavat suuret tipat, jotka lopulta houkuttelevat painovoimaa.
Tiettyyn määrän höyryä on vapautettava sama energia, mutta vastakkaisella merkinnällä AH: llaHöyry; toisin sanoen sen tiivistymisen entalpia ΔHCond. Siten käänteinen, höyry-nestetasapaino on vakaa.
Kostutetut ikkunat
 Vesikonsenssi. Lähde: Pexels
Vesikonsenssi. Lähde: Pexels Tiivistyminen voidaan havaita itse kotitalousikkunoissa. Kylmällä säällä talon sisällä oleva vesihöyry törmää ikkunan kanssa, jolla materiaalillaan on alhaisempi lämpötila kuin muilla pinnoilla.
Siellä on höyrymolekyylien ryhmittelyä helpompaa, jolloin luomalla ohut valkeahko kerros on helposti irrotettava käsin. Kun nämä molekyylit vapauttavat lämmön (lämmityslasi ja ilma), ne alkavat muodostaa enemmän useita klustereita, kunnes ne voivat tiivistää ensimmäiset pudotukset (ylempi kuva).
Kun pudotukset lisäävät suuresti kokoaan, ne liukuvat ikkunan läpi ja jättävät veden polun.
- Jähmettyminen
Jähmoditeetti on aineen tilan muutos nestemäisestä tilasta kiinteään tilaan.

Jähmähdytys tapahtuu jäähdytyksestä; Toisin sanoen vesi jäätyy. Jäädyttääkseen veden on vapautettava sama määrä lämpöä, joka imee jäätä sulamaan. Tätä lämpöä kutsutaan jälleen jähmettymisestä tai jäädyttäväksi entalpiaksi, ΔHKong (-AhFus-A.
Jäähdytettäessä vesimolekyylit menettävät energiaa ja niiden molekyylien väliset vuorovaikutukset vahvistuvat ja suuntautuvat enemmän. Seurauksena on, että ne tilataan vety sillansa ansiosta ja muodostavat niin kutsutut jääkiteet. Mekanismi, jolla jääkiteet kasvavat niiden ulkonäköön: läpinäkyvä tai valkoinen.
 Jääveistos. Lähde: Pixabay
Jääveistos. Lähde: Pixabay Jos jääkiteet kasvavat hyvin hitaasti, nämä eivät sulje epäpuhtauksia, kuten kaasuja, jotka alhaisissa lämpötiloissa liuotetaan veteen. Siten kuplat pakenevat eikä voi olla vuorovaikutuksessa valon kanssa; Ja sen seurauksena on, että jäätelö on yhtä läpinäkyvä jään (ylivoimainen kuva).
Sama, joka tapahtuu jäällä, voi tapahtua millä tahansa muulla aineella, joka jähmettyy jäähdytyksellä. Ehkä tämä on monimutkaisin fyysinen muutos maanpäällisissä olosuhteissa, koska useita polymorfeja voidaan saada.
- Sublimaatio
Sublimointi on aineen tilan muutos kiinteästä kaasusta.

Voi vesien sublim? Ei, ainakaan normaaleissa olosuhteissa (t = 25 ° C, p = 1 atm). Sublimointia tapahtuu, toisin sanoen kaasun kiinteän tilan muutos, kiinteän aineen höyrynpaine on oltava korkea.
Samoin on välttämätöntä, että heidän molekyylien väliset voimat eivät ole kovin vahvoja, mieluiten, jos ne koostuvat vain dispersiovoimista
Tunkein esimerkki on kiinteä jodi. Se on kiteinen kiinteä kiinteä moraaliset sävyt, jolla on korkea höyrynpaine. Sellainen on niin, että hänen toiminnassaan seuraa violetti höyry, jonka tilavuus ja laajennus ovat merkittäviä, kun hän on lämmittävä.
Voi palvella sinua: trietilamiini: rakenne, ominaisuudet, käytöt ja riskit Jodin sublimointi. Lähde: Belkina N V [CC BY 4.0 (https: // creativecommons.Org/lisenssit/by/4.0)], Wikimedia Commons
Jodin sublimointi. Lähde: Belkina N V [CC BY 4.0 (https: // creativecommons.Org/lisenssit/by/4.0)], Wikimedia Commons Yläkuvassa esitetään tyypillinen koe, jossa kiinteä jodi haihtuu lasisäiliössä. On mielenkiintoista ja silmiinpistävää tarkkailla, kuinka violetteja höyryjä levitetään, ja aloitettu opiskelija voi tarkistaa nestemäisen jodin puuttumisen.
Tämä on sublimaation pääominaisuus: nestefaasia ei ole läsnä. Se on myös endoterminen, koska kiinteä kiinteä absorboi lämpöä nostamaan höyrynpaineen yhtä suureksi kuin ulkoinen paine.
- Talletus
 Joo -kristallinpoisto. Lähde: Stanislav.Nevehosteny [cc by-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons
Joo -kristallinpoisto. Lähde: Stanislav.Nevehosteny [cc by-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons Laskeutuminen on aineen tilan muutos kaasumaisesta tilasta kiinteään tilaan.
Jodin sublimaatiokokeen rinnalla sinulla on laskeuma. Laskeutuminen on päinvastainen muutos tai siirtyminen: aine kulkee kaasumaisesta tilasta kiinteäksi ilman nestefaasin muodostumista.
Kun jodin purppuran höyryt joutuvat kosketuksiin kylmän pinnan kanssa, ne vapauttavat lämpöä lämmittääkseen sitä, menettäen energiaa ja ryhmittyvät uudelleen molekyyleihinsa uudelleen harmahtavan muddy-kiinteässä kiinteässä kiinteistössä (ylivoimainen kuva). Se on sitten eksoterminen prosessi.
Laskeutumista käytetään laajasti materiaalien synteesiin, joissa ne ovat doping metalliatomien kanssa hienostuneiden tekniikoiden avulla. Jos pinta on hyvin kylmä, lämmönvaihto sen ja höyryhiukkasten välillä on äkillinen, jättäen kulun vastaavan nestefaasin läpi.
Laskeuman lämpö tai entalpia (eikä Talletus) on sublimaation (ΔHSub=- ΔHD.E.P-A. Teoriassa lukuisia aineita voidaan sublimoida, mutta tämän saavuttamiseksi on välttämätöntä manipuloida paineita ja lämpötiloja sen lisäksi, että sen P vs t -kaavio on käsillä; jossa niiden kaukaiset mahdolliset vaiheet voidaan visualisoida.
Muut valtion muutokset
Vaikka niitä ei mainita, on muitakin aineita. Joskus heille on ominaista, että sillä on "vähän kutakin", ja siksi yhdistelmä heistä. Niiden tuottamiseksi paineet ja lämpötilat tulisi manipuloida erittäin positiivisiin (suuriin) tai negatiivisiin (pieniin) suuruuksiin.
Siten esimerkiksi, jos kaasut lämmitetään suuresti, ne menettävät elektronit ja positiivisesti ladattuja ytimensä kyseisessä negatiivisessa vuorovesi muodostaa niin kutsutun plasmana. Se on synonyymi "sähkökaasulle", koska sillä on korkea sähkönjohtavuus.
Toisaalta, kun lämpötilat laskeutuvat liikaa, asia voi käyttäytyä epäilemättä; Eli niillä on ainutlaatuisia ominaisuuksia absoluuttisen nollan (0 k) ympärillä.
Yksi näistä ominaisuuksista on tarpeeton ja suprajohtavuus; samoin kuin Bose-Einstein-kondensaatin muodostuminen, missä kaikki atomit käyttäytyvät yhtenä.
Jopa jotkut tutkimukset viittaavat fotoniseen aineeseen. Niissä sähkömagneettisen säteilyn hiukkaset, fotonit, on ryhmitelty muodostamaan fotonisia molekyylejä. Toisin sanoen se antaisi massan joillekin valon runoille, teoreettisesti.
Viitteet
- Helmestine, Anne Marie, PH.D -d. (19. marraskuuta 2018). Luettelo vaihemuutoksista aineen tilan välillä. Toipunut: Admingco.com
- Wikipedia. (2019). Aineen tila. Haettu: vuonna.Wikipedia.org
- Dorling Kindersley. (2007). Muuttuva tila. Toipunut: factmonster.com
- Meyers ami. (2019). Vaiheen muutos: haihdutus, kondensaatio, vapautus, sulaminen, sublimointi ja laskeuma. Opiskelu. Toipunut: Opiskelu.com
- Bagley m. (11. huhtikuuta 2016). Aine: Määritelmä ja viisi aineen tila. Toipunut: LivesCience.com
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- « Termodynamiikan kaavojen toinen laki, yhtälöt, esimerkit
- Kaliumjodidi (KI) -rakenne, ominaisuudet, hankkiminen, käyttö, riskit »

