Pihistoria, ominaisuudet, rakenne, hankkiminen, käyttö

- 2365
- 389
- Shawn Stanton II
Hän pii Se on ei -metallinen elementti ja samalla metalloidi, jota edustaa kemiallinen symboli, jos. Se on puolijohde, joka on olennainen osa tietokoneita, laskimia, matkapuhelimia, aurinkokennoja, diodeja jne.; Pääkomponentti on käytännössä sallinut digitaalisen aikakauden ratkaisun.
Pii on aina ollut läsnä kvartsissa ja silikaatissa, molemmat mineraalit, jotka koostuvat noin 28% koko maankuoren massasta. Se on siten toiseksi runsain elementti maan pinnalla, ja aavikoiden ja rantojen laajuus tarjoaa näkökulman kuinka runsas se on.
 Aavikot ovat runsaasti piidioksidihiukkasten tai graniitien luonnollinen lähde muiden mineraalien kanssa. Lähde: Pxhere.
Aavikot ovat runsaasti piidioksidihiukkasten tai graniitien luonnollinen lähde muiden mineraalien kanssa. Lähde: Pxhere. Pi. Siksi tätä elementtiä pidetään tetravalenttina metalloidina; Siinä on neljä Valencian elektronia, ja teoriassa voit menettää ne kaikki muodostamaan kationin4+.
Kiinteistö, joka jakaa hiilen kanssa, on sen kyky ketjuttaa; Eli niiden atomit on kytketty kovalenttisesti molekyyliketjujen määrittelemiseksi. Samoin pii voi muodostaa omat "hiilivedyt", nimeltään Siltans.
Luonnon hallitsevat piiyhdisteet ovat kuuluisia silikaatteja. Puhtaan muodossaan se voi esiintyä kiinteänä monokiteisenä, polyristaliinina tai amorfisena. Se on suhteellisen inertti kiinteä, joten se ei edusta huomattavia riskejä.
[TOC]
Historia
Piikivi
Pii on ehkä yksi niistä elementeistä, joilla on ollut eniten vaikutusta ihmiskunnan historiaan.
Tämä elementti on kivikauden päähenkilö ja myös digitaalinen aikakausi. Heidän alkuperänsä ovat peräisin, kun sivilisaatiot työskentelivät kvartsin kanssa ja tekivät oman lasinsa; Ja tällä hetkellä se on tietokoneiden, kannettavien tietokoneiden ja älypuhelimien pääkomponentti.
Käytännössä pii on ollut kahden aikakauden kivi, joka on selvästi määritelty historiassamme.
Eristäytyminen
Kun piidioksidia oli niin runsasta, Flint Rockista syntynyt nimi, sen piti sisältää erittäin rikas elementti maankuoressa; Tämä oli onnistunut epäily Antoine Lavoisierista, joka epäonnistui vuonna 1787 yrittäessään vähentää sitä oksidistaan.
Jonkin aikaa myöhemmin, vuonna 1808 Humphry Davy yritti omia yrityksiä ja osoitti etunimensä elementille: 'piium', joka käännetty olisi kuin 'pedernal metal'. Toisin sanoen piitä siihen mennessä pidettiin metallina karakterisoinnin puutteen vuoksi.
Sitten, vuonna 1811 ranskalaiset kemistit Joseph L. Gay-Lussac ja Louis Jacques Thénard onnistuivat valmistamaan amorfisen piin ensimmäistä kertaa. Tätä varten he reagoivat piidaterafluoridia metallisella kaliumilla. He eivät kuitenkaan puhdista tai karakterisoidut tuotetta, joten he eivät päättäneet, että se oli uusi piiumelementti.
Se ei ollut muuta kuin vuonna 1823, kun ruotsalainen kemisti Jacob Berzelius sai amorfisen piin, jolla oli riittävä puhtaus tunnistaa se piiksi; Skotlantilaisen kemisti Thomas Thomsonin vuonna 1817 antama nimi pitäen sitä ei -metallisesta elementistä. Berzelius suoritti reaktion kaliumin ja sulan kaliumfluorosilikaattin välillä tämän piin tuottamiseksi.
Kiteinen pii
Kiteinen pii valmistettiin ensimmäistä kertaa vuonna 1854 ranskalainen kemisti Henry DeVille. Tämän saavuttamiseksi DeVille teki elektrolyysin alumiini- ja natriumkloridien seoksesta, jolloin saatiin piikiteitä, jotka oli peitetty alumiinikerroksella, joka eliminoi (ilmeisesti) pesemällä ne vedellä vedellä.
Fysikaaliset ja kemialliset ominaisuudet
Fyysinen ulkonäkö
 Alkuperäinen pii, jolla on metallinen kiilto, mutta se on oikeastaan metalloidi. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]
Alkuperäinen pii, jolla on metallinen kiilto, mutta se on oikeastaan metalloidi. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Piihämuoto koostuu sinertävästä harmahtavasta tai mustasta kiinteästä (ylivoimaisesta kuvasta), joka ei ole metalli.
Se on kova, mutta hauras kiinteä, jolla on myös okaspinta, jos sen muodostaa polyristales. Toisaalta amorfinen pii näyttää tummanruskealta jauheelta kiinteältä. Tämän ansiosta on helppo tunnistaa ja erottaa yksi tyyppinen pii (kiteinen tai polyristaliini) toisesta (amorfisesta).
Moolimassa
28.085 g/mol
Atominumero (z)
14 (14Joo)
Sulamispiste
1414 ºC
Kiehumispiste
3265 ºC
Tiheys
-Huoneenlämpötilassa: 2,33 g/ml
-Aivan sulamispisteessä: 2,57 g/ml
Huomaa, että nestemäinen pii on tiheämpi kuin kiinteä pii; mikä tarkoittaa, että heidän kiteensä kelluvat nestemäisessä vaiheessa, kuten jäävesijärjestelmän kanssa. Selitys johtuu tosiasiasta, että atomien välinen interatominen tila, jos sen lasissa on suurempi (vähemmän tiheää), kuin vastaava nesteessä (tiheämpi).
Sulamislämpö
50,21 kJ/mol
Höyrystyslämpö
383 kJ/mol
Molaarinen lämpökapasiteetti
19 789 J/(mol · k)
Elektronegatiivisuus
1.90 Pauling -asteikolla
Ionisaatioenergiat
-Ensimmäinen: 786,5 kJ/mol
-Toinen: 1577,1 kJ/mol
-Kolmas: 3231,6 kJ/mol
Atomiradio
111 PM (mitattuna niiden timanttikiteissä)
Lämmönjohtokyky
149 w/(m · k)
Sähkövastus
2.3 · 103 Ω · m - 20 ºC
Mohsin kovuus
6.5
Ketju
Piiliatomilla on kyky muodostaa yksinkertaisia Si-Si-linkkejä, jotka lopulta määrittelevät ketjun (Si-si-si ...).
Tämä ominaisuus ilmenee myös hiili ja rikki; SP -hybridisaatiot kuitenkin3 Piestä on puutteellisempia verrattuna kahteen muuhun elementtiin, ja lisäksi niiden 3p -kiertoradat ovat hajaampia, joten kiertoradan SP: n päällekkäisyys3 Tuloksena on heikompi.
Voi palvella sinua: Exotermisiä ja endotermisiä reaktioitaSi-Si- ja C-C-kovalenttisten sidosten keskimääräiset energiat ovat vastaavasti 226 kJ/mol ja 356 kJ/mol. Siksi Si-IF-linkit ovat heikompia. Tämän vuoksi pii ei ole elämän kulmakivi (eikä rikki). Itse asiassa pisin ketju tai luuranko, jonka pii voi muodostua, on yleensä neljä jäsentä (jos4-A.
Hapetusluvut
Piillä voi olla jokin seuraavista hapetuslukuista, olettaen,4-), -3 (kyllä3-), -2 (kyllä2-), -1 (kyllä-), +1 (kyllä+), +2 (kyllä2+), +3 (kyllä3+) ja +4 (kyllä4+-A. Kaikista niistä -4 ja +4 ovat tärkeimpiä.
Esimerkiksi -4 oletetaan Siliciurosissa (MG2Kyllä tai mg22+Joo4-) kun taas +4 vastaa piidioksidia (SiO2 tai jos4+JOMPIKUMPI22--A.
Reaktiivisuus
Pii on täysin liukenematon veteen, samoin kuin vahvat hapot tai emäkset. Se kuitenkin liukenee väkevöityyn seokseen typpihapoja (HNO3-Hf). Samoin se liukenee kuumaan alkaliseen liuokseen, seuraava kemiallinen reaktio:
Kyllä (s) + 2NAOH (AC) + H2Tai (l) => na2Sitoa3(AC) + 2H2(g)
Natriummetasilikaatti, na2Sitoa3, Se muodostuu myös, kun pii liukenee sulaan natriumkarbonaattiin:
Kyllä (s) + na2Yhteistyö3(L) => na2Sitoa3(L) + c (s)
Huoneenlämpötilassa se ei reagoi ollenkaan hapen kanssa, edes 900 ° C: ssa, kun siio -suojaava lasimainen kerros alkaa muodostua2; Ja sitten, 1400 ° C: ssa, pii reagoi ilmatypen kanssa nitrhure -seoksen muodostamiseksi3N4.
Pii reagoi myös korkeissa lämpötiloissa metallien kanssa metallien Silicicosin muodostamiseksi:
2 mg (s) + kyllä (s) => mg2Kyllä (s)
2Cu (s) + kyllä (s) => cu2Kyllä (s)
Huoneen lämpötilassa se reagoi räjähtäväksi ja suoraan halogeenien kanssa (siiokerroksia ei ole2 joka suojaa sitä tältä). Esimerkiksi, sinulla on SIF -muodostelureaktio4-
Kyllä (s) + 2f2(g) => sif4(g)
Ja vaikka pii on liukenematon veteen, punainen elossa reagoi höyryvirran kanssa:
Kyllä (s) + h2Tai (g) => si2(s) + 2h2(g)
Elektroninen rakenne ja kokoonpano
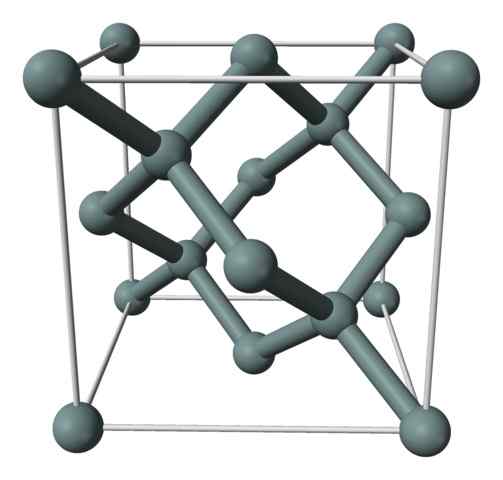 Kiteinen rakenne tai piin yhtenäinen solu, jota edustaa pallo- ja tankojen mallia. Lähde: Benjah-BMM27 [julkinen alue]
Kiteinen rakenne tai piin yhtenäinen solu, jota edustaa pallo- ja tankojen mallia. Lähde: Benjah-BMM27 [julkinen alue] Yläkuva näyttää kuutiometrin rakenteen, joka on keskitetty kasvoihin (FCC), samoin kuin timantin, piikristallille. Harmaat pallot vastaavat atomeja, jos ne ovat, kuten arvostetaan, ne on kovalenttisesti kytketty toisiinsa; Lisäksi heillä on tetraedrisia ympäristöjä, jotka lisääntyvät lasia pitkin.
Piekite on FCC, koska atomi havaitaan, jos se sijaitsee kuution jokaisessa pinnassa (6 × 1/2). Kuutiossa on myös kahdeksan atomia (8 × 1/8) ja sen sisällä sijaitsevat neljä (8 × 1/8) (ne, jotka osoittavat hyvin määritellyn tetraedronin heidän ympärillään, 4 × 1).
Edellä mainittiin, jokaisessa yksikkökennossa on yhteensä kahdeksan piisyatomia (3 + 1 + 4, yllä olevassa kappaleessa ilmoitetut numerot); Ominaisuus, joka auttaa selittämään sen korkean kovuuden ja jäykkyyden, koska puhdas pii on kovalenttinen kide ja timantti.
Kovalenttinen merkki
Tämä kovalenttinen merkki johtuu tosiasiasta, että hiilen, kuten Piilessä, on neljä valenssielektronia sen elektronisen kokoonpanon mukaan:
[Ne] 3s2 3P2
Linkittämiseksi puhtaat orbitaalit 3s ja 2p ovat hyödytöntä. Siksi atomi luo neljä SP -hybridi -kiertorataa3, Jonka avulla voit muodostaa neljä Si-si-kovalenttisia sidoksia ja tällä tavalla täydentää Valencian oktetti kahdelle piisyatomille.
Piukide visualisoidaan sitten kovalenttiseksi ja kolmiulotteiseksi verkkoksi, joka koostuu toisiinsa kytketystä tetraedrasta.
Tämä verkko ei kuitenkaan ole täydellinen, koska se esittelee vikoja ja viljarajoja, jotka erottuvat ja määrittelevät kide toisesta; Ja kun tällaiset kiteet ovat hyvin pieniä ja lukuisia, puhuu polyristaliinista kiinteästä aineesta, joka tunnistetaan sen heterogeenisella kirkkaudella (samanlainen kuin huijattu mosaiikki tai pintahopea).
Sähkönjohtavuus
SI-IF-yhteydet hyvin sijoitettuihin elektroneihinsa on periaatteessa eri mieltä siitä, mitä metallilta odotetaan: elektronien meri "kostuttaa" heidän atomejaan; Ainakin tämä on niin huoneenlämpötilassa.
Kun lämpötila nousee, pii alkaa kuitenkin ajaa sähköä ja siksi käyttäytyy kuin metalli; Eli se on puolijohde -metalloidielementti.
Amorfinen pii
Piilatteerit eivät aina omaksua rakenteellista mallia, vaan ne voidaan järjestää epäjärjestyksellisellä tavalla; Ja jopa piidiomilla, joiden hybridisaatiot näyttävät olevan SP3 mutta SP2, joka myötävaikuttaa edelleen häiriön asteen lisäämiseen. Siksi on puhetta amorfisesta ja ei -kiteisestä.
Amorfisessa piissä on elektronisia avoimia työpaikkoja, joissa joillakin niiden atomeista on kiertorata elektronin kanssa. Tämän ansiosta sen kiinteä kiinteä voi vetyä itse, mikä johtaa vetyamorfisen piin muodostumiseen; toisin sanoen siinä on Si-H-linkit, joiden kanssa tetraedra on valmis häiriöllisissä ja mielivaltaisissa asemissa.
Voi palvella sinua: interatomiset linkitTämä osa päättyy sitten sanomalla.
Jokaisella heistä on oma menetelmä tai tuotantoprosessi, samoin kuin sovellukset ja dilemma päätettäessä, mitä kolmesta käytetään, tietäen heidän edut ja haitat.
Missä se on ja saa
 Kvartsikiteitä (piidioksidia) ovat yksi tärkeimmistä ja poikkeuksellisimmista mineraaleista, joissa pii sijaitsee. Lähde: James St. John (https: // www.Flickr.com/valokuvat/jsjgeology/22437758830)
Kvartsikiteitä (piidioksidia) ovat yksi tärkeimmistä ja poikkeuksellisimmista mineraaleista, joissa pii sijaitsee. Lähde: James St. John (https: // www.Flickr.com/valokuvat/jsjgeology/22437758830) Pii on maailmankaikkeuden seitsemänneksi runsain elementti ja toinen maankuoressa, rikastuttaen myös maan vaippaa valtavan mineraaliperheen kanssa. Tämä elementti liittyy poikkeuksellisen hyvin happea, muodostaen laajan valikoiman oksideja; Heidän joukossaan, piidioksidi, niin2, ja silikaatit (monipuolinen kemiallinen koostumus).
Piidioksidia voidaan nähdä paljaalla silmällä aavikoissa ja rannoilla, koska hiekka koostuu pääasiassa siimasta2. Tämä oksidi puolestaan voi ilmetä muutamassa polymorfissa, jotka ovat yleisin: kvartsi, ametisti, akaatti, christobalite, tripoli, koesiitti, sishovita ja thandimita. Lisäksi sitä löytyy amorfisista kiinteistä aineista, kuten opaalit ja piimat.
Sillä välin silikaatit ovat vielä rikkaampia rakenteellisesti ja kemiallisesti. Joidenkin silikaattien mineraalien joukossa voidaan mainita: asbesti (valkoinen, kahvi ja sinertävä), maasälpä, savet, mykiset, oliivi, alumiinin, zeoliitit, sammakko- ja pyrokseenit.
Käytännössä kaikki kivet koostuvat piista ja happesta, niiden SI-O.
-Piidioksidin vähentäminen
Pian saamista edustaa ongelma on rikkoa tämä SI-O. Tämän prosessin raaka -aine on kvartsin muotoinen piidioksidi, joka liikkuu aiemmin, kunnes se on hieno jauhe.
Tästä maasta piidioksidia voidaan valmistaa joko amorfisella piillä tai polyristaliinilla.
Amorfinen pii
Pienessä mittakaavassa, joka on valmistettu laboratoriossa ja asiaankuuluvilla toimenpiteillä, piidioksidi sekoitetaan magnesiumpölyn kanssa sulatuskantissa ja poltetaan ilman ilman. Seuraava reaktio tapahtuu sitten:
Sitoa2(s) + mg (s) => 2mgo (s) + kyllä (s)
Magnesium ja oksidi eliminoidaan laimennetulla suolahappoliuoksella. Sitten jäljellä oleva kiinteä kiinteä aine käsitellään fluoriaruokahapolla, niin että se viimeistelee reagointia SIO: sta2 liiassa määrin; Muutoin ylimääräinen magnesium suosii sen vastaavan Siliciuron muodostumista, Mg2Kyllä, ei -toivottu yhdiste prosessiin.
SIO2 Se muuttuu sif -haihtuvaksi kaasuksi4, joka otetaan talteen muille kemiallisille synteesille. Lopuksi amorfinen pii taikina kuivataan kaasun vetyvirran alla.
Toinen samanlainen menetelmä amorfisen piin saamiseksi on käyttää samaa SF: tä4 aiemmin valmistettu tai sicl4 (aiemmin hankittu). Näiden piin halogeenien höyryt ohitetaan nestemäisen natriumin yli inertissä ilmakehässä, jotta kaasun pelkistys voidaan antaa ilman happea:
Sicl4(g) + 4na (l) => kyllä (s) + 4nacl (l)
Mielenkiintoista on, että amorfisella piillä valmistetaan korkean energian suorituskyvyn aurinkopaneeleja.
Kiteinen pii
Alkaen uudelleen jauhemaisesta piidioksidista tai kvartsista, ne viedään sähkökaariuuniin, missä se reagoi koksin kanssa. Tällä tavoin pelkistävä aine ei ole enää metalli, vaan korkea puhtaus hiilipitoinen materiaali:
Sitoa2(s) + 2c (s) => kyllä (s) + 2co (g)
Reaktiossa tuotetaan myös piiharbidia, SIC, joka neutraloidaan ylimääräisellä SIO: lla2 (Jälleen kvartsi on liiallisesti):
2SIC (s) + siali2(s) => 3Si (s) + 2co (g)
Toinen menetelmä kiteisen piin valmistamiseksi on alumiinin käyttäminen pelkistävänä aineena:
3Sio2(s) + 4Al (l) => 3Si (s) + 2Al2JOMPIKUMPI3(S)
Ja alkaen kaliumheksafluorurosilikaatista, k2[SIF6], se reagoi myös metallialumiinin tai kaliumin kanssa saman tuotteen aiheuttamiseksi:
K -k -2[SIF6] (l) + 4Al (l) => 3Si (s) + 6kf (l) + 4Alf3(g)
Heti pii liukenee sulaan alumiiniin, ja kun järjestelmä jäähtyy, ensimmäinen kiteytyy ja erottuu toisesta; Eli muodostuu piisekiteitä, jotka näyttävät harmahtavilta väreiltä.
Polyristaliini -pii
Toisin kuin muut synteesi tai tuotannot, polyristaliini -piin saamiseksi, se alkaa silanokaasumaisella faasilla, SIH4. Tämä kaasu käy läpi pyrolyysin, joka on yli 500 ° C, siten, että lämpöhajoaminen tapahtuu ja siten sen alkuperäiset höyryt, ne lopulta tallettavat piipolyristalleja puolijohdepinnalle.
Seuraava kemiallinen yhtälö kuvaa tapahtuvaa reaktiota:
Kyllä h4(g) => kyllä (s) + h2(g)
Kammiossa ei selvästikään pitäisi olla happea, koska se reagoi SIH: n kanssa4-
Kyllä h4(g) + 22(g) => SiO2(s) + 2h2O (g)
Ja palamisreaktion spontaanisuus on sellainen, joka tapahtuu nopeasti huoneenlämpötilassa kasvoissa.
Toinen synteettinen reitti tämän tyyppisen piidiosan tuottamiseksi kiteisestä piista raaka -aineena. Ne saavat sen reagoimaan vetykloridin kanssa lämpötilassa noin 300 ° C, niin että triklorosilano muodostuu:
Voi palvella sinua: Rauta (elementti): Ominaisuudet, kemiallinen rakenne, käyttöKyllä (s) + 3HCl (g) => sicl3H (g) + h2(g)
Ja SICL3H reagoi 1100 ºC: seen piin uudistamiseksi, mutta nyt polyristaliini:
4Sicl3H (g) => kyllä (s) + 3sicl4(g) + 2h2(g)
Riittää näkemään yhtälöt, jotka antavat käsitys työstä ja tiukat tuotantoparametrit, jotka on harkittava.
Isotoopit
Pii on luonnollisesti ja pääasiassa isotooppina 28Kyllä, runsaasti 92,23%.
Tämän lisäksi on olemassa kaksi muuta isotooppia, jotka ovat stabiileja eivätkä siksi kärsi radioaktiivisesta rappeutumisesta: 29Kyllä, runsaasti 4,67%; ja 30Kyllä, runsaasti 3,10%. Niin runsas 28Kyllä, ei ole yllättävää, että piin atomipaino on 28 084 U.
Pii voi olla myös useissa radioisotoopeissa, joista 31Joo (t1/2= 2,62 tuntia) ja 32Joo (t1/2= 153 vuotta). Muut (22Joo - 44Jos heillä on t1/2 Hyvin lyhyt tai lyhyt (alle sadasosa sekunnista).
Riskejä
Puhdas pii on suhteellisen inertti aine, joten se ei yleensä keräänty mihin tahansa elimeen tai kudokseen niin kauan kuin altistuminen siihen on alhainen. Pölymuodossa se voi aiheuttaa silmien ärsytyksiä, aiheuttaen kyyneleitä tai punoitusta, kun taas koskettaminen voi aiheuttaa ihon epämukavuutta, kutinaa ja kuorinta.
Kun altistuminen on erittäin korkea, pii voi satuttaa keuhkoja; Mutta ilman myöhempiä vaikutuksia, ellei määrä riittää aiheuttamaan tukehtumista. Tätä ei kuitenkaan tapahdu kvartsilla, joka liittyy keuhkosyöpään ja sairauksiin, kuten keuhkoputkentulehdukseen ja emfyseemaan.
Samoin puhdas pii on luonteeltaan hyvin harvinainen, ja sen yhdisteet, niin runsas maankuoressa, eivät edusta mitään ympäristölle riskiä.
Nyt nämä voivat olla myrkyllisiä elimissä; Mutta monien niistä riippuvat siitä, kumpi harkitaan, samoin kuin muut tekijät (reaktiivisuus, pH, toimintamekanismi jne.-A.
Sovellukset
Rakennusteollisuus
Piilineraalit integroivat "kiven", jonka kanssa rakennukset, talot tai muistomerkit on rakennettu. Esimerkiksi sementit, betoni, stukki ja tulenkestävät tiilet koostuvat kiinteistä seoksista, jotka perustuvat silikaatteihin. Tästä lähestymistavasta voi ilmestyä apuohjelmaksi, joka tällä elementillä on kaupungeissa ja arkkitehtuurissa.
Lasi ja keramiikka
Piidioksidista voidaan valmistaa optisiin laitteisiin käytettyjä kiteitä, joko eristeinä, soluissa spektrofotometrien näytteille, pietsosähköisiä kiteitä tai pelkkiä laseja.
Lisäksi, kun materiaali valmistetaan useilla lisäaineilla, se lopulta muuttuu amorfiseksi kiinteäksi, joka tunnetaan nimellä Glass; ja hiekkavuoret ovat yleensä piidioksidi- tai kvartsilähde, joka tarvitaan sen tuotantoon. Toisaalta valmistetaan keraamisia ja posliinimateriaaleja.
Yhdistäviä ideoita, piitä on myös käsitöissä ja koristeissa.
Seokset
Piiliatomit voivat yhtenäisiä ja sekoittuvat metallimatriisin kanssa, joten se on lisäaine lukuisille seoksille tai metalleille; Esimerkiksi teräs, magneettisten ytimien valmistukseen; pronssit puhelinkaapeleiden valmistukseen; ja alumiini, alumiinihankkien seoksen tuotannossa kevyille autoosille.
Siksi sitä ei vain löydy rakennusten "kivistä", vaan myös niiden pylväiden metalleista.
Kuivut
 Gelatiinoidut piidioksidipallot, joita käytetään kuivausaineena. Lähde: DiSiccants [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Gelatiinoidut piidioksidipallot, joita käytetään kuivausaineena. Lähde: DiSiccants [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Piidioksidi, geelin tai amorfisen muodossa, mahdollistaa kiinteiden aineiden valmistuksen, jotka toimivat kuivausaineena, kun tarttuvat vesimolekyyleihin, jotka tulevat astiaan ja ylläpitävät sisätiloja kuivana.
Elektroninen teollisuus
 Aurinkopaneelien valmistukseen käytetään polyristaalista ja amorfista piistä. Lähde: Pxhere.
Aurinkopaneelien valmistukseen käytetään polyristaalista ja amorfista piistä. Lähde: Pxhere. Eri paksuuksien ja värin piihakerrokset ovat osa tietokonelastuja, samoin kuin niiden kiinteä (kiteinen tai amorfinen), integroituja piirit ja aurinkokennot on suunniteltu.
Puolijohteena, atomit sisällytetään vähemmän (Al, B, GA) tai enemmän elektroneja (P, AS, SB) sen muuttamiseksi tyyppisiksi puolijohteiksi p jompikumpi n, vastaavasti. Kahden Silios -liiton kanssa, yksi n ja se toinen p, Valmistetaan kevyiden emitterien diodeja.
Silikonipolymeerit
Kuuluisa silikoniliima koostuu orgaanisesta polymeeristä, jota tukee Si-O-Si-linkkien ketjujen stabiilisuus ... lopulliset sovellukset.
Sen käyttötarkoituksen joukossa seuraavat voidaan mainita alla:
-Liimaa tai liimoja, ei vain liittymään papereihin, myös rakennuslohkoihin, kumiin, lasipaneeliin, kiviin jne.
-Voiteluaineet hydraulisissa jarrujärjestelmissä
-Vahvistaa maalauksia ja parantaa niiden värien kirkkautta ja voimakkuutta, mikä antaa sinun vastustaa lämpötilan muutoksia ilman halkeilua tai Carcomea
-Niitä käytetään veden hylkivinä suihkeina, jotka ovat kuivuneet joitain pintoja tai esineitä
-Ne antavat henkilökohtaisia hygieniatuotteita (hammaspasta, shampoo, geelit, partakoneet jne.) Silkkisen tunne
-Sen pinnoitteet suojaavat herkät laitteiden elektroniset komponentit lämmöltä ja kosteelta, kuten mikroprosessorit
-Silikonipolymeereillä useita pomppimista kumipalloista putoaa tuskin lattiaan.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Pii. Haettu: vuonna.Wikipedia.org
- Mikrokemikaalit. (S.F.-A. Piin kristallografia. Talteenotettu: mikrokemikaalit.com
- Lentech b.V. (2019). Jakson taulukko: Pii. Toipunut: lentech.com
- Marques Miguel. (S.F.-A. Pii tapahtuu. Toipunut: Nautilus.Fis.UC.Pt
- Enemmän hemant. (5. marraskuuta 2017). Pii. Toipunut: Hemantmore.org.sisään
- Pilgaard Michael. (22. elokuuta 2018). Pii: esiintyminen, eristäminen ja synteesi. Toipunut: Pilgaardelegs.com
- DR. Doug Stewart. (2019). Piielementti tosiasiat. Kemikooli. Toipunut: Chemicool.com
- Christiana Honsberg ja Stuart Bowden. (2019). Kokoelma resursseja aurinkosähköopettajalle. Pvetucation. Haettu: pvetucation.org
- American Chemistry Council, Inc. (2019). Silikonit jokapäiväisessä elämässä. Toipunut: SEHSC.Amerikkalainen.com

