Solvaatio
- 1869
- 132
- Arthur Terry II
Mikä on solvaatio?
Se Solvaatio Liuoksessa on fysikaalinen ja kemiallinen liitto liuenneen aineen ja liuottimen hiukkasten välillä. Se eroaa liukoisuuden käsitteestä siinä, että kiinteän ja sen liuenneiden hiukkasten välillä ei ole termodynaamista tasapainoa.
Tämä liitto vastaa liuenneista kiintoaineista, jotka "katoavat" katsojien huomioon ottaen; Todellisuudessa hiukkasista tulee hyvin pieniä ja lopulta "kääritty" liuotinmolekyylilevyillä, mikä tekee niistä mahdotonta tarkkailla niitä.

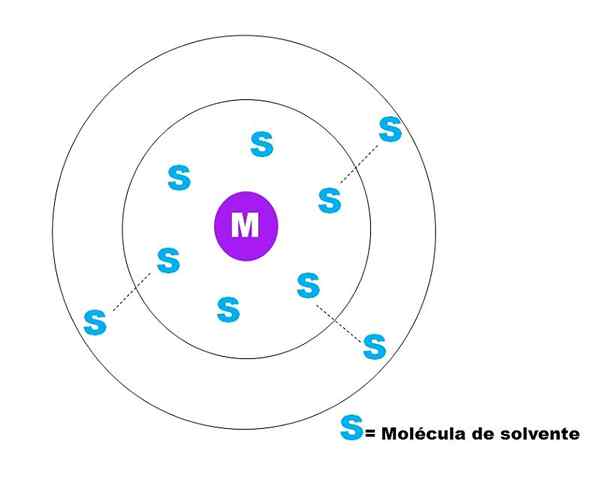
Yläkuvassa on esitetty hyvin yleinen luonnos hiukkasen m liukenemisesta. M voi olla kunnossa (m+) tai molekyyli; Ja S on liuotinmolekyyli, joka voi olla mikä tahansa yhdiste nestemäisessä tilassa (vaikka se voi olla myös kaasua).
Huomaa, että M: tä ympäröi kuusi s, jotka muodostavat niin Ensisijainen solvaatioalue. Muut M -molekyylit korkeammalla etäisyydellä vuorovaikutuksessa van der Waalsin voimien kanssa entisen kanssa muodostaen toissijaisen ratkaisun ja niin edelleen, kunnes kaikki tilaukset ovat ilmeisiä.
Solvaatioprosessi
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Molekyylisesti, miten solvaatioprosessi on? Yläkuva on yhteenveto tarvittavista vaiheista.
Siniset liuotinmolekyylit on alun perin määrätty vuorovaikutukseen keskenään (S-S); Ja liuenneen aineen, purppuran, ionit (ionit tai molekyylit) tekevät samat vahvoilla tai heikkoilla M-M-vuorovaikutuksilla.
Solvaation toteuttamiseksi sekä liuottimen että liuenneen aineen on laajennettava (toinen musta nuoli), jotta liuenneen liuotin vuorovaikutukset (M-S) voidaan mahdollistaa.
Tämä tarkoittaa välttämättä liuenneen liuotin ja liuotinvuorovaikutusten vähenemistä; väheneminen, joka vaatii energiaa, ja siksi tämä ensimmäinen askel on endoterminen.
Kun liuennut aine ja liuotin ovat laajentuneet molekyylisesti, sekoita ja vaihda paikkoja avaruudessa. Jokaista toisen kuvan violetti ympyrää voidaan verrata ensimmäiseen kuvaan.
Voi palvella sinua: Kalsium: Ominaisuudet, rakenne, hankkia, käyttääHiukkasten tilausasteen muutos voidaan kuvassa yksityiskohtaisesti; tilattu alussa ja sotkuinen lopussa. Seurauksena on, että viimeinen vaihe on eksoterminen, koska uusien vuorovaikutusten muodostuminen stabiloi kaikki liuoksen hiukkaset.
Energian näkökohdat
Solvaatioprosessin takana on monia energianäkökohtia, jotka on otettava huomioon. Ensimmäinen: vuorovaikutukset S-S, M-M ja M-S.
Kun M-S-vuorovaikutukset, toisin sanoen liuenneen aineen ja liuottimen välillä, ne ovat paljon parempia (vahvoja ja vakaita) verrattuna yksittäisiin komponentteihin, puhuu eksotermisestä ratkaisuprosessista; Ja siksi energiaa vapautetaan ympäristöön, joka voidaan varmistaa mittaamalla lämpötilan nousu lämpömittarilla.
Jos päinvastoin, vuorovaikutukset M-M ja S-S ovat vahvempia kuin M-S, niin "laajeneminen" tarvitsevat enemmän energiaa kuin se, jonka he ansaitsevat, kun solvaatio huipentuu.
Sitten puhutaan endotermisestä ratkaisuprosessista. Tätä tapausta on lämpötila vähenee tai mikä on sama, ympäristö viileä.
On olemassa kaksi perustavanlaatuista tekijää, jotka hallitsevat, liukenee liuenneena liuottimeen vai ei. Ensimmäinen on liukenemisliuoksen muutos (ΔHDis), Kuten selitettiin, ja toinen on entropian (ΔS) muutos liuenneen aineen ja liuenneen liuenneen aineen välillä. Yleensä ΔS liittyy myös edellä mainitun häiriön lisääntymiseen.
Molekyylien väliset vuorovaikutukset
Mainittiin, että solvaatio on seurausta liuenneen ja liuottimen välisestä fysikaalisesta ja kemiallisesta liitosta; Kuitenkin kuinka nämä vuorovaikutukset tai ammattiliitot ovat tarkalleen?
Jos liuennettu aine on ioni, m+, Ns. Ion-dipolo-vuorovaikutukset tuotetaan (M+-S); Ja jos se on molekyyli, niin on dipoli-dipolo-vuorovaikutuksia tai Lontoon dispersiovoimia.
Voi palvella sinua: Sykloheksaani: rakenne, käyttötarkoitukset, konformaatiotKun puhut Dipolo-Dipolo-vuorovaikutuksista, sanotaan, että M: ssä on pysyvä dipolimomentti. Siten alue, joka on runsaasti elektroneja Δ-, on vuorovaikutuksessa S: n elektronin Δ+: n huonon alueen kanssa. Kaikkien näiden vuorovaikutusten tulos on useiden solvaatioiden muodostuminen M ympärille.
Lisäksi on olemassa muun tyyppisiä vuorovaikutuksia: koordinaatio. Tässä muodon koordinaatioyhteyksien (tai datiivi) molekyylit muodostavat erilaisia geometrioita.
Perussääntö liuenneen ja liuottimen välisen affiniteetin muistamiseksi ja ennustamiseksi on: yhtä suuri liukenee. Siksi polaariset aineet liukenevat helposti liuottimiin yhtä napaisesti; ja apolaariset aineet, liukenevat apolaarisiin liuottimiin.
Erot solvaation ja nesteytyksen välillä
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Kuinka nesteytyksen ratkaiseminen on erilainen? Kaksi identtistä prosessia, paitsi siksi, että S S, ensimmäisen kuvan, korvataan veden prosesseilla, H-O-H.
Ylemmässä kuvassa voit nähdä kationin m+ kuuden tunnin molekyylien ympäröimä2JOMPIKUMPI. Huomaa, että happea (punaiset) atomit on suunnattu positiiviseen kuormaan, koska se on elektronegatiivisin ja siksi sillä on suurin negatiivinen tiheys δ-.
Ensimmäisen hydraatiopallon takana muut vesimolekyylit on ryhmitelty vety silloilla (OH2-vai niin2-A. Nämä ovat ion-dipolo-tyyppisiä vuorovaikutuksia. Vesimolekyylit voivat kuitenkin muodostaa myös koordinaatiosidoksia positiivisen keskuksen kanssa, varsinkin jos se on metallinen.
Siten kuuluisa Aquocomplejos, M (OH2-An. Kuten kuvassa n = 6, kuusi molekyyliä on suunnattu M ympärille koordinaation oktaedron (nesteytyksen sisäinen pallo). M: n koosta riippuen+, Sen kuorman suuruus ja elektroninen saatavuus, sanoi, että pallo voi olla pienempi tai isompi.
Voi palvella sinua: kromioksidi (III): rakenne, nimikkeistö, ominaisuudet, käyttötarkoituksetVesi on ehkä kaikkein yllättävin liuotin: se liukenee mittaamattoman määrän liuenneita aineita, se on liian polaarinen liuotin ja siinä on epänormaalin korkea dielektrisyysvakio (78.5 K).
Esimerkkejä ratkaisusta
Alla on kolme esimerkkiä veden liukenemisesta.
Kalsiumkloridi
Kun liuennettua kalsiumkloridia veteen, lämpö vapautuu, kun Ca -kationit ratkaistaan2+ ja cl -anionit-. CA2+ Sitä ympäröi useita vesimolekyylejä, jotka ovat yhtä suurempia kuin kuusi (CA2+-vai niin2-A.
Myös Cl- Sitä ympäröivät vetyatomit, veden A+ -alue (Cl--H2JOMPIKUMPI). Vapautuvaa lämpöä voidaan käyttää jäämassaan sulamiseen.
Urea
Urean tapauksessa se on orgaaninen molekyyli, jolla on H -rakenne2N-Co-NH2. Ratkaistuaan H -molekyylit2O Muodosta vety sillat kahden Amining-ryhmän kanssa (-NH2-vai niin2) ja karbonyyliryhmän kanssa (c = o- h2JOMPIKUMPI). Nämä vuorovaikutukset ovat vastuussa niiden suuresta liukoisuudesta vedessä.
Myös sen liukeneminen on endoterminen, ts. Se jäähdyttää vesisäiliötä, johon se lisätään.
Ammoniumnitraatti
Ammoniumnitraatti, kuten urea, on liuenneaine, joka jäähdyttää liukenemisen sen ionien liuottimen jälkeen. NH4+ Solvata samalla tavalla kuin CA2+, Vaikka luultavasti siksi, että se on tetraedrinen geometria, on vähemmän H -molekyylejä2Tai hänen ympärillään; Ja ei3- Solvata samalla tavalla kuin cl -anionit- (Vai niin2-JOMPIKUMPI2Ei2JOMPIKUMPI).
Viitteet
- Whitten, Davis, Peck & Stanley. Kemia. (8. ed.-A. Cengage -oppiminen.
- Belford R. (S.F.-A. Solvaatioprosessit. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Guppy Surf. (S.F.-A. Solvaatioprosessi. Haettu: Surfgupy.com

