jaksollinen elementtitaulukko
- 691
- 102
- Shawn Stanton II
Mikä on elementtien jaksollinen taulukko?
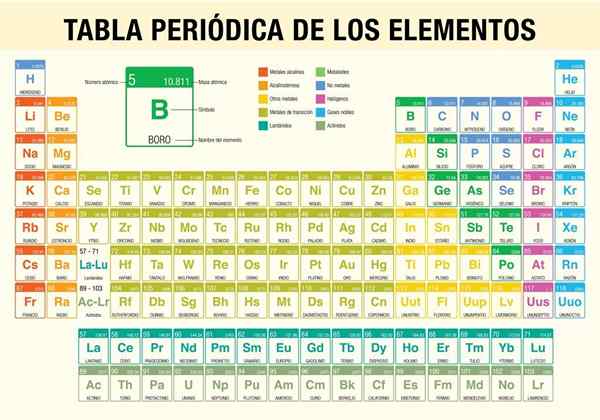
Se jaksollinen elementtitaulukko Se on työkalu, jonka avulla voit kuulla tähän mennessä tunnetun 118 elementin kemiallisia ominaisuuksia. Se on välttämätöntä, kun suoritetaan stökiömetrisiä laskelmia, ennustamalla elementin fysikaalisia ominaisuuksia, luokittelemalla ne ja löytävät säännöllisiä ominaisuuksia kaikista niiden joukosta.
Atomit muuttuvat raskaammiksi, koska niiden ytimet lisäävät protoneja ja neutroneja, joihin on myös liitettävä uusia elektroneja; Muuten elektroneutraalisuus ei olisi mahdollista. Siten jotkut atomit ovat erittäin kevyitä, kuten vety ja toiset, superpesadot, kuten Oganerson.
Se oli tiedemies Dmitri Mendeléyev, joka vuonna 1869 (melkein 150 vuotta sitten) julkaistiin teoreettisten tutkimusten ja kokeiden vuosikymmenen jälkeen ensimmäisen jaksollisen taulukon yrittäessään organisoida tuolloin tunnetut 62 elementtiä.
Mikä on jaksollinen taulukko?
Taulukon pääkäyttöä ovat:
- Tunne kunkin olemassa olevan kemiallisen elementin symboli ja nimi.
- Tunne elementin atomimassa ja atomiluku.
- Ilmoittaa eri elementtien välisistä suhteista.
- Näytä erilaiset trendit (jaksollisuus).
- Kemiallisten elementtien tyyppien luokittelu. Näihin tyyppeihin kuuluvat alkalimetallit, emäksiset metallit, siirtymämetallit, ei -metallit, jalokaasut, halogeenit, alkaliset maat, semmetalit, aktinidit ja lantanidit.
- Ennusta uusien elementtien ominaisuuksia, joita ei vielä löydetty tai joita ei ole syntetisoitu.
Kuinka jaksollinen taulukko järjestetään? (Rakenne ja organisaatio)
Ajanjaksot
Elementit tilataan riveinä tai ajanjaksoina sen kiertoratojen energiatasosta riippuen. Ennen ajanjaksoa 4, kun elementit seurasivat lisääntyvässä atomimassan järjestyksessä, se oli, että jokaiselle kahdeksan niistä kemialliset ominaisuudet toistettiin uudelleen (John Newlands Octavesin laki).
Siirtymämetallit hiipivät muihin ei -metallisiin elementteihin, kuten rikki ja fosfori. Tästä syystä kvanttifysiikan ja elektronisten kokoonpanojen pääsy nykyaikaisten jaksollisten taulukoiden ymmärtämiseksi oli elintärkeää.
Energiakerroksen kiertoradat täytetään elektroneilla (ja protonien ja neutronien ytimillä), kun se liikkuu ajanjakson aikana. Tämä energiakerros kulkee käsi kädessä atomiskoko tai radio; Siksi korkeamman ajanjakson elementit ovat pienempiä kuin alla olevat.
H ja I ovat löytäneet ensimmäisestä (jakson) energiatasosta; Ensimmäinen harmaasävyjen rivi neljännellä jaksolla; ja Ananjadas -laatikoiden rivi kuudennessa jaksossa. Huomaa, että vaikka jälkimmäinen näyttää olevan väitetyssä yhdeksännessä jaksossa, se todella kuuluu kuudenteen, heti keltaisen BA: n jälkeen.
Ryhmät
Kauden kiertueella on, että massa, protonien ja elektronien lukumäärä kasvaa. Samassa sarakkeessa tai ryhmässä, vaikka massa ja protonit vaihtelevat, niiden lukumäärä Valencia -kerroksen elektronit on sama.
Esimerkiksi ensimmäisessä sarakkeessa tai ryhmässä H: llä on vain yksi elektroni 1s kiertoradalla1, Kuten Li (2s1), Natrium (3s1), Kalium (4S1) Ja niin edelleen Francioon (7s1-A. Tämä numero 1 tarkoittaa, että näillä elementeillä on tuskin Valencia -elektroni, ja siksi ne kuuluvat ryhmään 1 (AI). Jokainen elementti on eri ajanjaksoina.
Laskematta vetyä, vihreää laatikkoa, sen alla olevat elementit ovat peräisin oransseista laatikoista ja niitä kutsutaan alkalisiksi metalleiksi. Vielä yksi oikeaan ruutuun mihin tahansa ajanjaksoon on ryhmä tai sarake 2; Eli sen elementeillä on kaksi valenssielektronia.
Voi palvella sinua: teoreettinen suorituskykyMutta kun muutat oikealle, ilman, että tietoa orbitaaleista D, saavutat Boro (B) tai ryhmän 13 (IIIA) -ryhmään; Ryhmän 3 (IIIB) tai Scandion (SC) sijasta (SC) sijasta. Kun otetaan huomioon orbitaalien D täyttäminen, harmaiden laatikoiden ajanjaksot alkavat kulkea: siirtymämetallit.
Protonien numerot vs. Valencian elektronit
Säännöllistä taulukkoa tutkittaessa sekaannusta voi syntyä atomiluku z: n tai ytimen kokonaisprotonien lukumäärän ja valenssielektronien määrän välillä. Esimerkiksi hiilellä on z = 6, ts. Siinä on kuusi protonia ja siksi kuusi elektronia (muuten se ei voisi olla atomi neutraalilla kuormalla).
Mutta näistä kuudesta elektronista, neljä on Valenciasta. Tästä syystä sen sähköinen kokoonpano on [he] 2s22 p2. [Hän] tarkoittaa kahta elektronia 1s2 suljetun kerroksen ja teoreettisesti eivät osallistu kemiallisten linkkien muodostumiseen.
Koska hiilellä on neljä valenssielektronia, "kätevästi" sijaitsee jaksollisen taulukon ryhmässä 14 (alv).
Hiilen alla olevissa elementeissä (kyllä, GE, SN, PB ja FL) on enemmän korkeammat atomien (ja atomien) numerot; Mutta jokaisella on yhteistä Valencian neljä elektronia. Tämä on avain ymmärrykseen siitä, miksi elementti kuuluu yhdelle ryhmälle eikä toiselle.
Jaksollisen taulukon elementit
S
Kuten selitettiin, ryhmille 1 ja 2 on ominaista yksi tai kaksi elektronia kiertoradalla S. Nämä orbitaalit ovat pallomaisia geometriaa, ja koska mikä tahansa näistä ryhmistä on syntynyt, elementit hankkivat kerroksia, jotka lisäävät niiden atomien kokoa.
Ne kemiallisten ominaisuuksien ja reagointitapojen vahvojen suuntausten esittämiseksi nämä elementit on järjestetty lohkoksi. Siksi alkalimetallit ja emäksismetallit kuuluvat tähän lohkoon. Tämän lohkon elementtien elektroninen kokoonpano on NS (1S, 2S jne.-A.
Vaikka helium -elementti on taulukon oikeassa yläosassa, sen elektroninen kokoonpano on 1s2 Ja siksi kuuluu tähän lohkoon.
Lohko P
Toisin kuin lohko, tämän lohkon elementit ovat täysin täydet kiertoradat, kun taas niiden P -orbitaalit jatkavat elektronien täyttämistä. Tähän lohkoon kuuluvien elementtien elektroniset kokoonpanot ovat NS -tyyppiä2NP1-6 (P -kiertoradalla voi olla yksi tai enintään kuusi elektronia täytettäväksi).
Joten missä osassa jaksollista taulukkoa on tämä lohko? Oikealla: vihreä, asunto ja siniset laatikot; Eli ei -metalliset elementit ja raskasmetallit, kuten vismutti (BI) ja lyijy (PB).
Alkaen boorista, NS -elektronisella kokoonpanolla2NP1, Hiili oikealla puolella lisää toisen elektronin: 2s22 p2. Sitten lohkon P -jakson 2 muiden elementtien elektroniset kokoonpanot ovat: 2s22 p3 (typpi), 2S22 p4 (happi), 2s22 p5 (fluori) ja 2s22 p6 (neon).
Jos alemmat ajanjaksot lasketaan, energiatasolla 3: 3 on23P1-6, Ja niin edelleen lohkon P loppuun.
Huomaa, että tärkein asia tässä lohkossa on, että ajanjaksosta 4 sen elementit ovat täysin täyttäneet kiertoradat (siniset laatikot oikealle). Yhteenvetona: S -lohko on jaksollisen taulukon vasemmalla puolella ja lohko P, oikealle.
Edustavat elementit
Mitkä ovat edustavat elementit? He ovat niitä, jotka toisaalta menettää elektronit helposti tai toisaalta he voittavat heidät Valencian oktetin loppuun saattamiseksi. Toisin sanoen: ne ovat lohkojen S ja P elementtejä.
Voi palvella sinua: emulgoija: emulsioprosessi, molekyyliset näkökohdat, sovelluksetHeidän ryhmänsä erottuivat muista lopussa olevan kirjaimen A avulla. Siten ryhmiä oli kahdeksan: AI: sta VIIIA: een. Mutta tällä hetkellä nykyaikaisissa jaksollisissa taulukoissa käytetty numerointijärjestelmä on arabia, 1-18, mukaan lukien siirtymämetallit.
Tästä syystä Boro -ryhmä voi olla IIIA tai 13 (3+10); hiiliryhmä, arvonlisävero tai 14; ja jalokaasut, viimeisen taulukon oikealla puolella, viiia tai 18.
Siirtymämetallit
Siirtymämetallit ovat kaikki harmaan laatikon elementit. Koko ajanjaksoidensa ajan heidän kiertoradallaan on täytetty, jotka ovat viisi ja joilla voi olla kymmenen elektronia. Koska kymmenen elektronin on täytettävä kiertoradat, niin on oltava kymmenen ryhmää tai sarakkeita.
Jokainen näistä vanhan numerointijärjestelmän ryhmistä oli nimetty roomalaisilla numeroilla ja lopussa olevalla kirjaimella B. Ensimmäinen ryhmä, Scandion, oli IIIB (3), rauta, koboltti ja nikkeli VIIIB, jolla oli hyvin samanlainen reaktiivisuus (8, 9 ja 10) ja sinkki IIB (12).
Kuten voidaan nähdä, arabialaisten lukujen ryhmien tunnistaminen on paljon helpompaa kuin roomalaisten numeroiden käyttäminen.
Sisäiset siirtymämetallit
Määräajan taulukon 6. ajanjaksosta, kiertoradat f alkavat olla energisesti saatavilla. Ne on täytettävä ensin kuin orbitaalit d; Ja siksi sen elementit on yleensä asetettu erilleen, jotta taulukkoa ei laajenneta liikaa.
Kaksi viimeistä jaksoa, oranssi ja harmahtava. Orbitaalia on F, jotka tarvitsevat neljätoista elektronia täytettäväksi, ja siksi on oltava neljätoista ryhmää.
Jos nämä ryhmät lisätään jaksolliseen taulukkoon, yhteensä on 32 (18 + 14) ja sillä on ”pitkänomainen” versio:
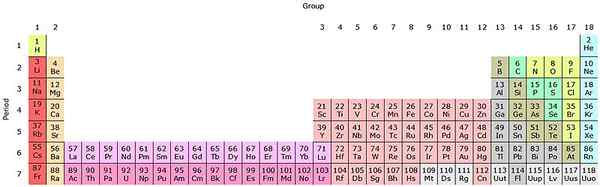 Lähde: Sandbh [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons
Lähde: Sandbh [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons Kirkas vaaleanpunainen rivi vastaa Lantanoidesia, kun taas tumman vaaleanpunainen rivi aktinoidit. Lantano, z = 57, aktinio, AC z = 89: llä ja koko lohko F kuuluu samaan skandion ryhmään. Koska? Koska skandiolla on nd orbitaali1, joka on läsnä muissa lantanoidissa ja aktinoideissa.
Ja AC: lla on 5D Valencia -asetukset16s2 ja 6d17s2. Kun siirryt oikealle molemmille riville, 4F- ja 5F -kiertoradat alkavat täyttää. Kun olet täynnä, pääset elementeihin Luthacio, Lu ja Laurencio, LR.
Metallit ja ei -metallit
Jättäen jaksollisen pöydän kakun taaksepäin, on helpompaa turvautua ylemmän kuvan kuvaan, jopa sen pitkänomaisessa muodossa. Tällä hetkellä suurin osa edellä mainituista elementeistä on ollut metalleja.
Huoneenlämpötilassa kaikki metallit ovat kiinteitä aineita (paitsi elohopea, joka on nestemäinen) hopeaharmaa (lukuun ottamatta kuparia ja kultaa). Ne ovat myös yleensä kovia ja loistavia; Vaikka lohkojen S ovat pehmeitä ja hauraita. Näille elementeille on ominaista helppo menettää elektronit ja muodostaa kationien m+.
Lantanoidien tapauksessa kolme elektronia menettävät 5d16s2 Tulla kolmiulotteiksi m3+ (kuin hän3+-A. Sillä välin mäki pystyy menettämään neljä elektronia (CE4+-A.
Toisaalta ei -metalliset elementit muodostavat vähiten osan jaksollisesta taulukosta. Ne ovat kaasuja tai kiinteitä aineita, joissa on kovalenttisesti kytkettyjä atomeja (kuten rikki ja fosfori). Kaikki sijaitsevat lohkossa P; Tarkemmin sanottuna sen yläosassa, kun laskeutuminen alempiin ajanjaksoihin lisää metallista luonnetta (BI, PB, PO).
Lisäksi ei -metallit sen sijaan, että menettäisivät elektronit, voittavat ne. Siten ne muodostavat anionit x- Erilaisilla negatiivisilla kuormituksilla: -1 halogeeneille (ryhmä 17) ja -2 kalsogeeneille (ryhmä 16, happi).
Voi palvella sinua: etyylialkoholi: rakenne, ominaisuudet, käyttötarkoitukset, hankkiminenMetalliperheet
Metallien sisällä on sisäinen luokitus niiden erottamiseksi:
- Ryhmän 1 metallit ovat emäksisiä.
- Ryhmä 2, alkalinerriortallit (SR. Scholambara).
- Ryhmä 3 (IIB) Scandion perhe. Tämä perhe koostuu Scandiosta, ryhmäpäälliköstä, Ititiumista ja Lantanon, Actinion ja kaikkien Lantanoides- ja Actinoides -ohjelmista.
- Ryhmä 4 (IVB), Titanium -perhe: TI, ZR (Circonium), HF (Hafnio) ja RF (Rutherfordio). Kuinka monta Valencia -elektronia on? Vastaus on ryhmässäsi.
- Ryhmä 5 (VB), Vanadio Family. Ryhmä 6 (VIB), Chrome -perhe. Ja niin edelleen sinkkiperheeseen, ryhmä 12 (IIB).
Metalloidit
Metallinen merkki kasvaa oikealta vasemmalle ja ylhäältä alas. Mutta mikä on näiden kahden kemiallisten elementtien välinen raja? Tämä raja koostuu elementeistä, joita kutsutaan metalloideiksi, joilla on sekä metallien että ei -metallien ominaisuuksia.
Metalloidit näkyvät boorilla alkavan portaikon jaksollisessa taulukossa ja päättyvät Astato -radioaktiiviseen elementtiin. Nämä elementit ovat:
- B: Boro.
- Pii: Kyllä.
- GE: Germanio.
- AS: Arseeni.
- SB: Antimoni.
- TE: Telurio.
- AT: Astato.
Jokaisella näistä seitsemästä elementille on väliominaisuuksia, jotka vaihtelevat kemiallisen ympäristön tai lämpötilan mukaan. Yksi näistä ominaisuuksista on puolijohto, ts. Metalloidit ovat puolijohteita.
Kaasut
Maanpäällisissä olosuhteissa kaasumaiset elementit ovat niitä ei -valon metalleja, kuten typpi, happi ja fluori. Myös kloori-, vety- ja jalokaasut tulevat tähän luokitteluun. Kaikista heistä symbolisimpia ovat jalokaasut, koska niiden taipumus reagoida ja käyttäytyä kuin vapaat atomit.
Jälkimmäinen löytyy jaksollisen taulukon ryhmästä 18 ja ovat: ovat:
- Helio, hän.
- Neon, NE.
- Argon, ar.
- Kripton, KR.
- Xenón, xe.
- Radón, rn.
- Ja viimeisin kaikista, jalo synteettinen oganilainen kaasu, OG.
Kaikilla jalokaasuilla on yhteinen Valencia NS -kokoonpano2NP6; Eli heillä on valmis Valencian oktetti.
Yhdistäminen toteaa muihin lämpötiloihin
Elementit ovat kiinteässä, nestemäisessä tai kaasumaisessa tilassa riippuen niiden vuorovaikutuksen lämpötilasta ja lujuudesta. Jos maan lämpötila jäähtyy, kunnes absoluuttinen nolla (0k) on lähellä, kaikki elementit jäätyisivät; paitsi heliumia, joka tiivistyisi.
Tässä äärimmäisessä lämpötilassa loput kaasut olisivat jään muodossa.
Toisaalta, jos lämpötila olisi noin 6000 kt, "kaikki" elementit olisivat kaasumaisessa tilassa. Näissä olosuhteissa kulta-, hopea-, lyijy- ja muut metallit pystyivät kirjaimellisesti havaitsemaan.
Jaksollisen taulukon merkitys
Tällä hetkellä jaksollinen taulukko on tärkein kemian organisaatioväline, koska sen elementtien yksityiskohtaiset suhteet johtuvat. Sen käyttö on välttämätöntä sekä opiskelijoille että opettajille sekä tutkijoille ja monille kemian ja tekniikan haaralle omistetuille ammattilaisille.
Kun tarkastellaan vain jaksollista taulukkoa, nopeasti ja tehokkaasti saadaan valtava määrä ja tiedot, kuten:
- Litium (Li), beryllium (BE) ja boori (b) Suorita sähköä.
- Litium on emäksinen metalli, beryllium on emäksinen metalli ja boori ei ole metalli.
- Litium on kolmen nimetyn paras kuljettaja, jota seuraa beryllium ja lopuksi boori (puolijohde).
Siten, sijoittamalla nämä elementit jaksollisesta taulukosta, sen taipumus sähkönjohtavuuteen voidaan tehdä heti.