Törmäysteoriajärjestelmät, energia, esimerkkejä
- 1349
- 167
- Shawn Stanton II
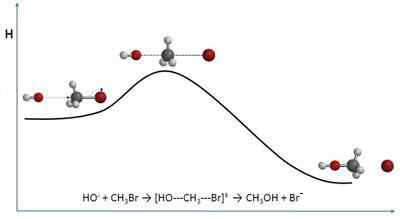
Se törmäysteoria Selitä kemiallisten reaktioiden nopeudet pelkästään molekyylin näkökulmasta. Siksi se on läheisesti lähellä kemiallista kinetiikkaa. Sen sijaan, että lähestyisi nopeuksia pitoisuuksien suhteen, se perustuu törmäystaajuuksiin.
Kun puhutaan törmäyksistä, joidenkin biljardipallojen kuva voi tulla mieleen vaikuttamaan toisiinsa pöydälle. Molekyylit, vaikka tämä teoria olettaa, että sen muodot ovat pallomaisia, älä käyttäytyy samalla tavalla. Molekyylin törmäykset eroavat toisistaan monella tavalla, sekä alueellisella että energialla.

Tämä teoria, vaikka se voi olla matemaattisesti hieman monimutkainen ja osoittaa huomattavia muunnelmia kokeellisista tuloksista, tarjoaa kuvan näkyvistä tulkinnoista ja ilman abstrakteja näkökohtia.
Vaikka sitä sovelletaan kaasumaisiin järjestelmiin tai hyvin laimennettuihin liuoksiin, sen periaatteet voivat ulottua mihin tahansa reaktioon ja fyysiseen väliaineeseen.
[TOC]
Reaktioiden olosuhteet tapahtuvat
Törmäysteorian mukaan reaktioiden esiintymisolosuhteet ovat kolme:
- Kemialliset lajit (ionit, molekyylit, radikaalit jne.) Niiden on törmättävä tehokkaasti.
- Heidän on kannettava tarpeeksi energiaa linkkien hajoamiseen.
- Lisäksi vaikutusten suuntautumisen on oltava hyvin erityisiä.
Molekyyliset törmäykset
 Kuten keilailu, reaktiot tapahtuvat vain, kun tehokkaat törmäykset tapahtuvat energian ja ohjauksen suhteen
Kuten keilailu, reaktiot tapahtuvat vain, kun tehokkaat törmäykset tapahtuvat energian ja ohjauksen suhteen Molekyylisööillä on jotain yhteistä makroskooppisen kanssa: ne esiintyvät pääasiassa kahden lajin tai ruumiin välillä. Kaksi biljardipalloa törmää toisiinsa, samoin kuin jalkapallopallo seinää vasten tai kaksi ammusta keskellä ilmaa. Toisin sanoen kemian ja sen reaktioiden törmäykset ovat yleensä bimolekyylityyppejä.
Voi palvella sinua: fysiikan ja kemian ionisaatio: käsite, prosessi ja esimerkitMolekyylit eivät ole vielä, mutta ne liikkuvat ja pyörivät niitä ympäröivän tilan läpi. Näin tehdessään oletetaan, että ne vetävät eräänlaisen ympyrän, jota kutsutaan poikkileikkaukseksi, jolla on todennäköisyys, että toinen Colison -molekyyli. Samoin teoria katsoo, että molekyylit ovat pallomaisia matemaattisten mallien yksinkertaistamiseksi.
Kaksi molekyyliä, hypoteettisesti pallomainen, voivat törmätä ilman mitään ongelmia, vaikka kemiallista reaktiota ei olisi. Mutta sitä ei tapahdu samalla tavalla, kun kyse on kolmesta, neljästä tai useammasta molekyylistä.
Mitä enemmän lajeja niiden tulisi törmää alkuperäiseen tuotteeseen, sitä epätodennäköisemmin ilmiö tulee. Tämä selitetään visuaalisesti yrittäen, että kolme palloa tai ammusta törmää samaan aikaan yhdessä. Siksi bimolekyyliset törmäykset ovat ylivoimaisesti yleisimmät.
Järjestelmä
Törmäysteoria pätee vain ohjelmistojärjestelmiin tai vaiheisiin. Tämä johtuu siitä, että kaasut osoittavat käyttäytymistä, jota heidän kinetiikansa voi kuvata hyvin.
Nestefaasissa tai erittäin laimennettuissa liuoksissa reaktiiviset lajit kääritään liuotinmolekyylimiin, jonka kanssa ne myös törmäävät. Tämä muuttaa panoraamaa, koska reaktiot eivät ole vain riippuvaisia törmäysten taajuuksista, vaan myös reagenssimolekyylien diffuusiosta väliaineen läpi.
Törmäysenergiat
Molekyylit voivat törmätä hitaasti tai nopeasti. Tämä riippuu siitä, kuinka suuri sen energia, mikä puolestaan vaihtelee merkittävästi lämpötilan mukaan. Mitä vahvempi törmäys, todennäköisyys, että kemiallinen reaktio kasvaa, koska tämä energia voi rikkoa tarvittavat yhteydet uusien muodostamiseksi.
Voi palvella sinua: monomeeritTätä energiaa kutsutaan aktivoitumiseksi ja-Lla, Ja se on ominainen kaikille kemiallisille reaktioille. Kun lämpötila nousee, molekyylien keskiarvo pystyy sovittamaan tai ylittämään E-Lla, Joten tehokkaiden törmäysten lukumäärä ja siksi muodostuneet tuotteet kasvavat.
Katalysaattorin läsnä ollessa ja-Lla vähenee, koska se tarjoaa pintoja ja elektronisia keinoja hyötykokoutumista. Tulos: Reaktionopeus kasvaa, nostamatta lämpötilaa tai lisäämällä muita reagensseja.
Steerinen tekijä
Kemialliset lajit törmäävät tehokkaasti reagoimaan, ennustaen tämän teorian, mikä on niiden reaktioiden nopeus. Kokeet ovat kuitenkin osoittaneet, että mitä monimutkaisemmat reagenssien rakenteet ovat, sitä suuremmat poikkeamat tai erot teoreettisten ja kokeellisten nopeuksien välillä.
Tämä johtuu siitä, että molekyylit ovat kaukana pallomaisista, mutta heillä on alueellisesti kaikenlaisia geometrioita. Täällä steerinen tekijä tulee, ρ, jonka kanssa se pyrkii korjaamaan reaktionopeudet siten, että teorian ennusteet kokeellisilla tuloksilla ovat parempia.
Esimerkkejä reaktioista
Bimolekyylireaktio
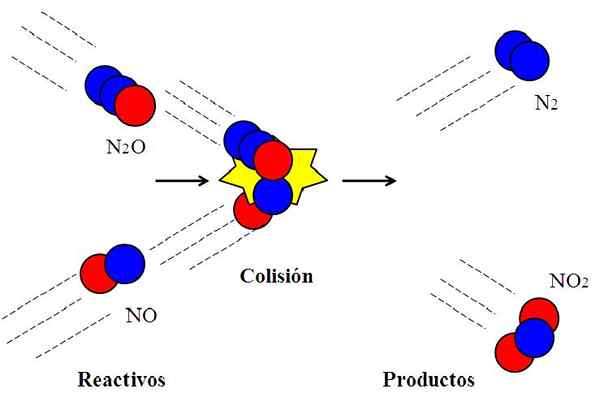 Tehokas törmäys typpioksidien välillä. Lähde: Gabriel Bolívar.
Tehokas törmäys typpioksidien välillä. Lähde: Gabriel Bolívar. Seuraava reaktio:
N2O + ei → n2 + EI2
Sitä käytetään yleisesti selittämään, mikä tehokas suuntaus tarkoittaa molekyylisotkimuksia.
Molekyyli n2Tai, dyitppioksidi, se ei reagoi NO: n kanssa, typpioksidin kanssa, ellei törmäyksen aikana N: n happiatomia (punainen ympyrä)2Tai shokki suoraan ei -typpiatomilla (sininen ympyrä). Vain tällä tavalla tuotteet n ovat peräisin2 ja ei2; Muuten n molekyylit2O ja he eivät pomppia reagoimatta.
Voi palvella sinua: Kaasumainen tila: Ominaisuudet, yleinen laki, esimerkkejäTämä on esimerkki bimolekulaarisesta törmäyksestä alkuaineen bimolekyylireaktiolle. Jopa silloin, kun reagenssit ovat tarpeeksi energiaa linkkien katkaisemiseksi, jos suunta ei ole tarkoituksenmukaista, kemiallista reaktiota ei tule olemaan.
Epätimolekyylinen reaktio
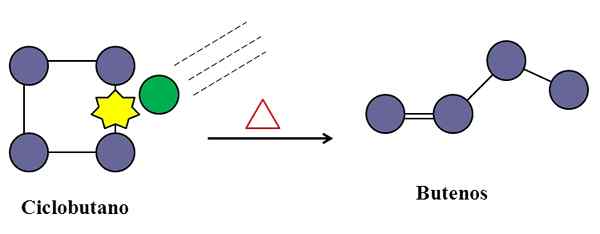 Törmäykset ovat myös välttämättömiä syklobutaanisarisoitumiselle. Lähde: Gabriel Bolívar.
Törmäykset ovat myös välttämättömiä syklobutaanisarisoitumiselle. Lähde: Gabriel Bolívar. Epäimolekyylisen alkuaineiden reaktiossa molekyylin törmäykset voivat myös puuttua asiaan, vaikka se olisi vain laji, joka kärsii sen linkkien muutoksesta tai hajoamisesta.
Harkitse esimerkiksi syklobutaanin isomerointia, jotta saadaan aikaan butaanien seos. Kun lämpötila nousee, syklobutaanimolekyylit värähtelevät korkeammilla taajuuksilla ja törmäävät suuremmalla voimalla. Tuotteet kuitenkin osoittavat, että kaksi syklobutaanimolekyyliä eivät reagoi toisiinsa, koska muuten ne tuottavat yhdisteen, jolla on kahdeksan hiilyä,.
Keskellä voi olla epäpuhtauksia (vihreä ympyrä), joka myös törmää syklobutaaniin, erityisesti sen C-C-linkillä. Nämä voivat olla jaloja kaasuja tai eivät kovin reaktiivisia molekyylejä, kuten typpeä.
Tulee aika, jolloin epäpuhtaus törmää riittävän energian kanssa rikkoaksesi yhden syklobutaanin C-C-yhteydet. Ja sitten sen molekyyli pyrkii järjestämään ja perustamaan buuteenin, joka on tunnistettava sen kaksoissidoksesta ja lineaarisesta ketjurakenteesta.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Glassi. (1970). Fysikaalis -sopimus. Aguilar s. -Lla. of Editions, Juan Bravo, 38, Madrid (Espanja).
- Walter J. Moore. (1962). Fysikaalinen kemia. (Neljäs painos). Longmanit.
- Wikipedia. (2020). Törmäysteoria. Haettu: vuonna.Wikipedia.org
- Enyclopaedia Britannica -toimittajat. (2020). Törmäysteoria. Britannica Encyclopaedia. Toipunut: Britannica.com
- Clark Jim. (2018). Reaktioasteen kolioteoria. Talteenotettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- Lawson P. & Lower S. (18. toukokuuta 2020). Colision -teoria. Kemian librettexts. Palautettu: Chem.Librettexts.org
- « Didaktiset tekstin ominaisuudet, rakenne, tyypit ja esimerkit
- Saaristo Amerikka tai Antilles -maat ja ominaisuudet »

