Happo-basasit Arrhenius, Bronsted-matalateoriat, Lewis

- 2774
- 602
- Arthur Terry II
 Kaavio, joka liittyy happojen ja emästen kolme pääteoriaa. Lähde: TEM5PSU, CC BY-SA 3.0, Wikimedia Commons
Kaavio, joka liittyy happojen ja emästen kolme pääteoriaa. Lähde: TEM5PSU, CC BY-SA 3.0, Wikimedia Commons Mitkä ovat happo- ja emästeoriat?
Happo- ja emästeoriat ovat joukko käsitteellisiä panoksia, jotka määrittelevät ja erottavat hapot ja emäkset, kaksi valtavan relevanssi -aineen konglomeraattia kemian aloilla.
Sen juuret ovat peräisin Robert Boylen vuonna 1661 tekemistä ensimmäisistä karakterisoinnista, jotka määrittelivät hapot, kuten hapan ja syövyttävät aineet, jotka muuttavat sinisen tai punaisen kevään paperin värin; Ja emäkset, kuten saippua -aineet, jotka toisin kuin hapot, muuttavat punaisen ja sinisen säärin värin.
Antoine Lavoisier ehdotti, että kaikki hapot sisältävät happiatomeja, kuten H2Sw4 ja hno3. Vuosisatoja myöhemmin vuonna 1811 Humphry Davy havaitsi, että monilla hapolla ei todellakaan ollut happiatomeja, kuten HCL, HF, HBR, jne.
Ja vähän ennen kuuluisan happo-emästen kolmion esiintymistä (ylivoimainen kuva), Justig Liebig ehdotti, että hapoissa on vetyatomeja, jotka voidaan korvata metallikationeilla.
Tämä empiirinen tieto toimi inspiraationa happojen ja emästen nykyisille teorioille: Arrhenius, Bronsted-Lowry ja Lewis. Kuten kaaviosta nähdään, Arrheniuksen teoria on rajoittavin tai rajoitetuin, kun taas Lewis's on yleisimpi ja globalisoitunein.
Arrhenius -teoria
Svante Arrhenius ehdotti vuoden 1884 mukaan hänen teoriansa mukaan hapot, kun vedessä liuenneena tuottavat ioneja H3JOMPIKUMPI+ tai h+; Kun tukikohdat liukenevat veteen, tuottavat tai vapauttavat OH -ionit-.
Ionit h3JOMPIKUMPI+ ja oh- Ne yhdistyvät palautuvassa reaktiossa, joka aiheuttaa vesimolekyylejä:
H3JOMPIKUMPI+ + vai niin- ⇌ 2h2JOMPIKUMPI
Voi palvella sinua: Disulfuriinihappo: Mikä on, rakenne, ominaisuudet, käyttötarkoituksetJoten arrheniushappo on myös se, joka lisää H -ionien pitoisuutta3JOMPIKUMPI+, Kun taas Arrhenius -emäs on yksi, joka lisää ionipitoisuutta OH-.
Tämä tarkoittaa, että arrheniushappo ei saisi välttämättä sisältää H -ioneja3JOMPIKUMPI+, Ja Arrhenius -pohjalla ei tarvitse olla OH -ioneja- Sen rakenteessa.
Esimerkki ja rajoitukset
Harkitse seuraavia dissosiaatioita:
Hcl (ac) → h+(AC) +CL-(AC)
NaOH (AC) → NA+(AC) +OH-(AC)
HCl on arrheniushappo, koska kun se on liuennut veteen, se tuottaa H -ioneja+, tai oikein, H -ionit3JOMPIKUMPI+. Ja toisaalta NaOH on Arrhenius -emäs, koska kun se liuenee veteen, OH -ionit vapautuvat-. Nämä aineet reagoivat toisiinsa tuottamaan suolaa ja vettä:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2JOMPIKUMPI
Arrhenius -teorian ongelma on siinä, että se on rajoitettu vain vesipitoisiin ratkaisuihin, ja siksi se koskee vain vettä liukenevia aineita. Esimerkiksi MGO on hyvin liukenematon veteen, ja silti se on emäksinen oksidi.
Se ei myöskään pysty selittämään itselleen, kuinka aineet kuten NH3 ja Cao tuottaa OH -ionit- liuennut veteen, vaikka heillä ei olisi ioneja OH- Sen molekyyli- tai kiteisessä rakenteessa (kuten NaOH: n tai KOH: n tapauksessa).
Ja hän ei selitä kuinka CO2 voi vapauttaa ionit H3JOMPIKUMPI+ Vedessä ilman vetyatomia sen molekyylirakenteessa (kuten HCL: n tai H: n tapauksessa2Sw4-A.
Brönsted-Lowry-teoria
Johannes Bronstedin ja Thomas Lewry, heidän happoteoriansa ja emästen teorian mukaan ehdotus erikseen vuonna 1923, että happo on kaikki aine, joka voi luovuttaa ionit H+, ja että pohja sen sijaan on mikä tahansa aine, joka pystyy hyväksymään nämä h+. Tämä teoria on yleisempi kuin Arrhenius ja kattaa useita sen rajoituksia.
Voi palvella sinua: molaariset ratkaisut: konsepti, valmistelu, esimerkitEsimerkki
Harkitse ne neutralointiyhtälöä uudelleen3JOMPIKUMPI+ Ja Voi- Kahden vesimolekyylin tuottaminen:
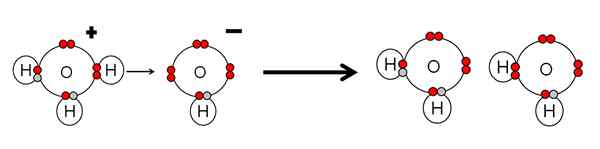 Esimerkki hapon neutraloinnista ja vesipohjasta. Lähde: Gabriel Bolívar.
Esimerkki hapon neutraloinnista ja vesipohjasta. Lähde: Gabriel Bolívar. Huomaa, että h3JOMPIKUMPI+ Tehty h+ joka välittömästi linkitetään tai koordinoidaan OH: n kanssa- oikea. Kun h+ Se päättyy yhteen OH: n elektronittomiin pareihin-, Kaksi neutraalia vesimolekyyliä pysyy tuotteina.
H3JOMPIKUMPI+ Siksi se on brnsted-matala happo, luovuttamiseen+, Ja oh- Se on brnsted-matala tukikohta tämän H: n hyväksymiseksi+.
Toinen esimerkki happo-emäsreaktiosta on seuraava:
Nh3(g) + hcl (g) → nh4Cl (s)
Tätä arrheniuksen mukaan tätä reaktiota ei voitu pitää happo-emästyyppinä, koska sitä ei tapahdu vesipitoisessa väliaineessa, vaan höyryfaasissa tai kaasumaisessa tilassa. NH3 Se on Brnsted -pohja, koska se hyväksyy HCL H: n luovuttamalla pari typpiatomilla sijaitsevaa elektronia; Ja HCl, looginen, tulee brnsted -happo.
Siten MGO on brnsted -pohja, koska se pystyy hyväksymään h+ happojen muuttamiseksi Mg: ksi (OH)2.
Lewis -teoria
Bronsted-Lowryn teoria selittää laajan spektrin happo-emäsreaktioita. Ohita ne reaktiot, joissa H -ionit+ ja oh- He eivät ole ollenkaan mukana, samoin kuin vapaiden elektronien suurempi osallistuminen molekyylimekanismeihin.
Siten vuonna 1923 g. N. Lewis ehdotti happo-emäsiteoriaa, joka sanoo seuraavan: happo on mikä tahansa aine, joka pystyy hyväksymään elektroniparit, kun taas emäksinen on sellainen, joka luovuttaa nämä elektroniparit.
Se voi palvella sinua: DAPI (4 ', 6-Diamidino-2-fenyylindoli): Ominaisuudet, perusta, käyttöEsimerkiksi ion h+ Se on Lewis -happo, koska se hyväksyy minkä tahansa lajin elektroniparit: H: stä2Tai aloittaa h3JOMPIKUMPI+, NH3 NH: n lähtökohtana4+, jne.
Esimerkki ja edut
Harkitse toista esimerkkiä seuraavassa reaktiossa:
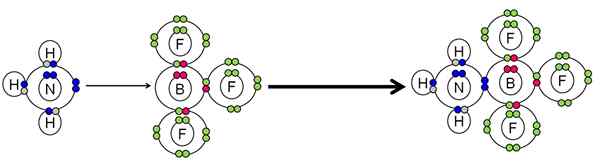 Esimerkki hapon ja Lewis -emäksen välisestä neutraloinnista. Lähde: Gabriel Bolívar.
Esimerkki hapon ja Lewis -emäksen välisestä neutraloinnista. Lähde: Gabriel Bolívar. NH3 Tehty typpiatomin elektronit (sininen) BF -booriatomiin3. Siksi NH3 Se on Lewisin pohja, koska lahjoittaa elektronipari ja BF3 Se on Lewisin happo, koska hän hyväksyy ne.
Yleensä kationi- ja köyhät elektronilajit ovat Lewis -happoja, kun taas anionit ja elektronit -rikkaat lajit ovat Lewis -emäksiä.
Tarjotut edut.
Esimerkiksi: h2O siinä on ilmaisia elektroneja happea. Jos lahjoitat yhden heistä ionille H+, toimii Lewisin tukikohdana, koska se on H+ Näin ollen Lewis -happo.
Bronsted-Lowryn mukaan H2Tai toimisin pohjana, koska se hyväksyy juuri h: n+ Lahjoittamalla pari heidän ilmaisia elektroneja. Ja lopuksi, h2Tai se on myös pohja Arrheniuksen teorian mukaan, koska H -ionien pitoisuus vähenee+ vesipitoisessa ympäristössä ja siten kasvattaa OH -ionien pitoisuutta-.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Clark Jim. (2002). Happojen ja emästen teoriat. Talteenotettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- Broderick C., Moussa m., & Clark J. (21. elokuuta 2020). Happojen ja emästen yleiskatsaus. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Wikipedia. (2020). Happosekan reaktio. Haettu: vuonna.Wikipedia.org
- Texas A&M -yliopisto. (S.F.-A. Hapot ja emäkset: happojen ja emästen kehitys. Palautettu: Chem.tamu.Edu

