Vety -silta -linkki
- 4173
- 1041
- Alonzo Kirlin
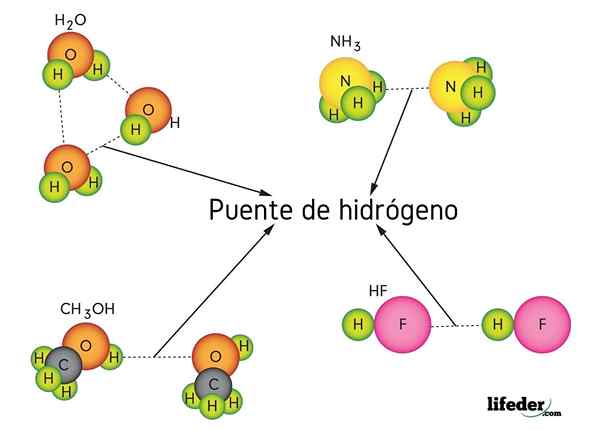
 Vetysilta vedessä (H2O), metanoli (CHO3OH), vetyfluoridi (HF) ja ammoniakki (NH3)
Vetysilta vedessä (H2O), metanoli (CHO3OH), vetyfluoridi (HF) ja ammoniakki (NH3) Mikä on vety -sillan linkki?
Vetysillan sidos on erityinen dipoli-dipolo-vuorovaikutus, joka kuuluu van der Waals -joukkoihin, joissa vetyatomi liittyy kahteen tai useampaan molekyyliin ilman kovalenttisesti kytkettyjä. Elektronilokerosta ei ole puhetta, vaan pääasiassa sähköstaattisesta ilmiöstä.
Kuten nimensä päättelee, vety toimii siltana, joten sen on oltava kahden atomin välillä. Vety on kytketty (H-X) erittäin elektronegatiiviseen atomiin (kuten N, O ja F) ja lähestyy toista elektronegatiivista atomia, mutta viereisestä molekyylistä. Tämä johtaa vetysillan muodostumiseen X ··· H-X.
Huomaa, että X ··· H-X-esityksessä pisteet symboloivat vetysillan, kun taas käsikirjoitus edustaa kovalenttisen sidoksen H: n ja x: n välillä. Katsotaanpa kuitenkin kahden vesimolekyylin välistä vety -siltaa, missä x on happiatomi: h: H2Tai ··· H-OH (alempi kuva).
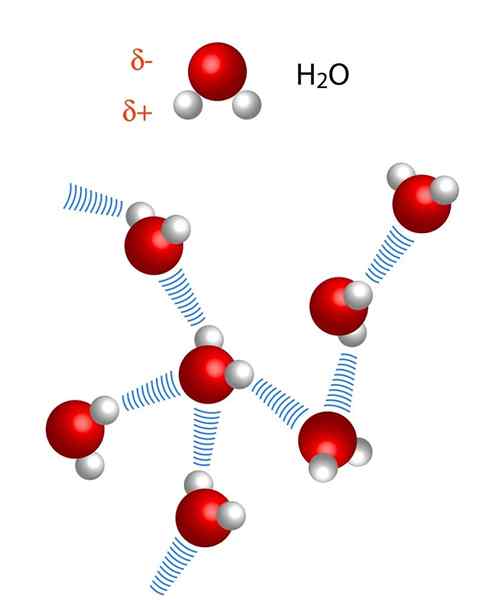
Yllä olevassa kuvassa näemme, että seitsemän vesimolekyyliä pysyy yhdessä niiden vety sillojen ansiosta, jotka edustavat sinisiä viivoja. Pelkästään vetysilta ei ole kovin vahva, mutta kun niitä on miljardeja, ne antavat asialle epänormaalit ja odottamattomat ominaisuudet.
Vetysillan ominaisuudet
Koostumus
Vetysilta tulisi todella edustaa x '··· H-X: ksi, missä x tunnetaan vetysillan luovuttajana, koska se on kovalenttisesti kytketty vetyyn (se antaa sen).
Samaan aikaan x 'on vetysillan vastaanottaja, läsnä viereisessä molekyylissä (vastaanottaa sen). Siten meillä on luovuttajaatomi (x), vety (H) ja vastaanottajaatomi (x '), joka säveltää vetysillan (x' ··· H-X).
Geometrinen
Kun ajattelemme siltaa, litteät tai kaarevat pinnat tulevat mieleen. Koska oletetaan, että linkit eivät käyrä, meillä on sitten kaksi etäisyyttä: x ··· H ja H-X, jotka muodostavat vety-sillan x ··· H-x.
Voi palvella sinua: peruuttamaton reaktio: Ominaisuudet ja esimerkitNäiden kahden etäisyyden välillä on kulma, joka on usein 180 °; Eli sillan kolme atomia lepäävät samassa vaakasuorassa (tai pystysuorassa) linjassa.
Kun kulma on erilainen kuin 180º, X ··· H-X-silta ei ole enää suora tai lineaarinen, mutta hankkii muita geometrioita.
Toisaalta vety sillojen etäisyydet eivät ole identtisiä. H-X-etäisyys on lyhyempi kuin x ··· H, joka voidaan nähdä vesimolekyylien kuvassa. Siten esimerkiksi H-X-etäisyys on yleensä klo 110 PM (1,10-12m), kun taas toinen etäisyys x ··· H on 160 PM.
Assosiatiivinen
Vetysillan erityisominaisuus on, että se mahdollistaa molekyylien liittyä toisiinsa paljon enemmän. He eivät kävele sivulta toiselle huomiotta toisiaan. Siksi se vahvistaa hetkellisen järjestyksen nesteiden rinnassa; Ja kiinteiden aineiden tapauksessa ne edistävät kiteiden määritelmää.
Jos näemme vety -sillan, voimme ajatella assosiaatiota ja siten tietyssä järjestyksessä (vaikkakin dynaaminen ja muuttuva) molekyyliasteikkoihin.
Energia
Vetysillan rikkominen ei ole kovin vaikeaa. Esimerkiksi vesimolekyylit kävelevät ja luovat joka kerta mobilisoimalla. Mutta monien rikkominen samanaikaisesti merkitsisi loputtoman määrän molekyylien häiriöitä. Puhumme sellaisen energian toimittamisesta, joka rikkoo näiden vety sillojen mooleja (6.02 · 1023 X ··· h-x).
Siten vetysillan voima vaihtelee molekyylien identiteetistä ja luonteesta riippuen. Esimerkiksi vetysillan tai ··· H-O: n voima veden ja alkoholin välillä on 5 kcal/mol: 5 kcal energiaa tarvitaan kyseisen vetysillan moolin katkaisemiseksi.
Voi palvella sinua: Kemialliset muutokset: Ominaisuudet, esimerkit, tyypitEsimerkkejä vety sillasta
Vettä
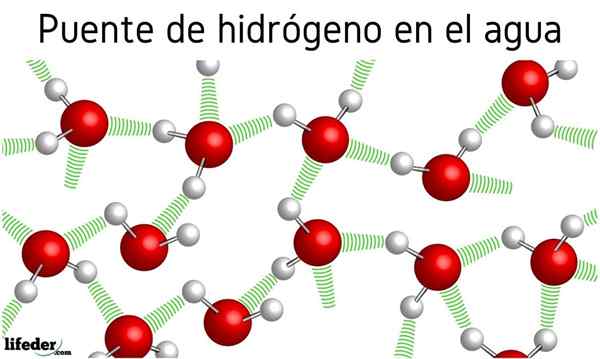
Aluksi puhuttiin vety sillasta vesimolekyylien välillä, mutta sillä vaikutusta niiden ominaisuuksiin ei mainittu. Niiden ansiosta vesi kiehuu 100 ° C2S, se kiehuu -60 ºC; tai h2Tiedän, keitä -41.25 ºC.
Tämä epämiellyttävä ero johtuu vesisiltoista, jotka myös määrittelevät muut niiden poikkeavat ominaisuudet, kuten niiden valtavat spesifiset lämpöä, jääkiteitä, niiden dielektristä vakioita jne.
Etanoli
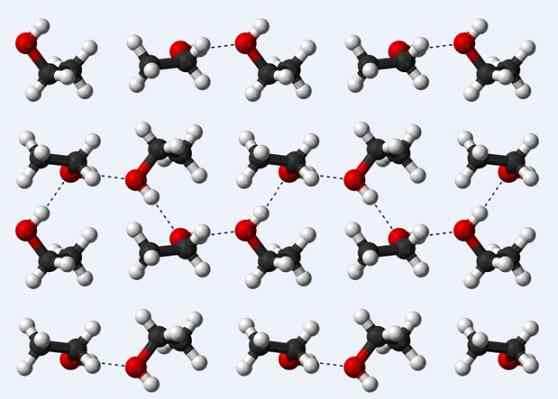 Vety sillat etanolikiteessä
Vety sillat etanolikiteessä Katsotaanpa nyt toinen vety -silta: yksi etanolimolekyylien välillä, ch3CH2Voi (yllä). Huomaa, kuinka molekyylit majoitetaan3CH2Voi siten, että niiden vety sillat ovat vakiintuneita3CH2Ho ··· hoch2CH3 (Pisteviivat).
Molekyylit on kuitenkin liian määrätty olettamaan, että puhumme nestemäisestä etanolista, mutta sen sijaan muodostavat lasin (kiinteä etanoli).
Etanolille kuvattu vety -silta on samanlainen kuin muiden alkoholien kanssa, erolla, että niiden hiilihapolliset luurankot voivat estää mainittujen siltojen tehokkuutta.
Etikkahappo
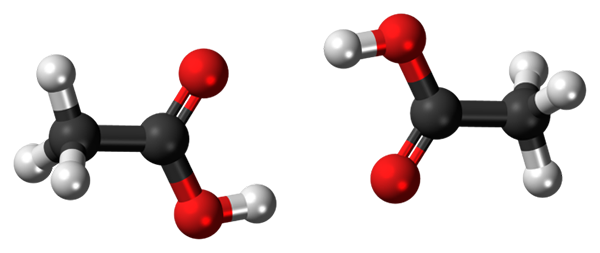 Vety sillat kahden etikkahappomolekyylin välillä. Lähde: Jynto, CC0, kautta Wikimedia Commons
Vety sillat kahden etikkahappomolekyylin välillä. Lähde: Jynto, CC0, kautta Wikimedia Commons Etikkahappo, CHO3COOH pystyy luomaan kaksi vety sillaa, jotka yhdistävät kaksi molekyyliä samanaikaisesti. Koska ne ovat kahta molekyyliä, jotka vety sillat yhdistävät, puhumme dimeeristä.
Huomaa, että yksi näistä vety sillasta on C = O ··· H-O ja toinen O-H ··· O = C. Etikkahappo esittelee erityispiirteet, että höyrynvaiheessa se on olemassa tämä dimeeri.
Se voi palvella sinua: mangaaninen tai permanganiinihappoSelluloosa
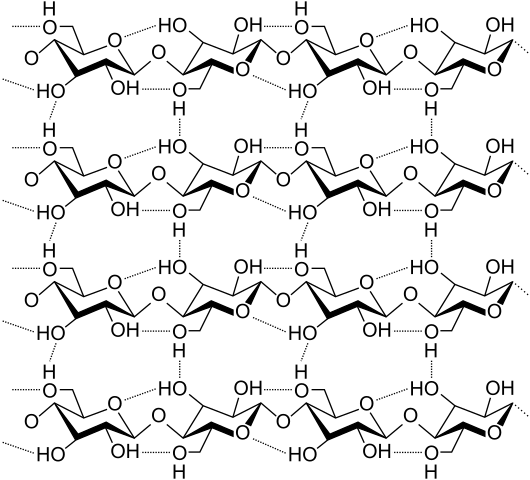 Vety sillat useiden selluloosaketjujen välillä. Lähde: Laghi.L, cc by-sa 3.0, Wikimedia Commons
Vety sillat useiden selluloosaketjujen välillä. Lähde: Laghi.L, cc by-sa 3.0, Wikimedia Commons Katsotaanpa nyt monimuotoisempia ja useita vety siltoja. Selluloosa, luonnollinen polymeeri, koostuu ketjuista, jotka koostuvat useista β-glukoosin yksiköistä.
Jokainen ketju pysyy kiinnitettynä toiseen monien vety siltojen ansiosta (ylivoimainen kuva), jotka vahvistavat koheesiota ketjujen välillä.
DNA
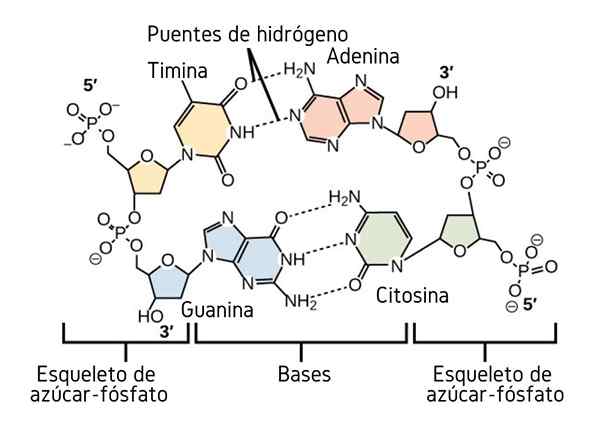 Vety sillat DNA: n typpipohjojen välillä. Lähde: CNX OpenStax, CC 4: llä.0, Wikimedia Commons
Vety sillat DNA: n typpipohjojen välillä. Lähde: CNX OpenStax, CC 4: llä.0, Wikimedia Commons Toistaiseksi olemme nähneet vety sillojen assosiatiivisen vaikutuksen määrätä järjestystä molekyylien välillä. Mutta entä makromolekyyli? Makromolekyylissä, kuten DNA: ssa, löydämme sisäisiä tai molekyylisiä vety silloja sen tymiinin, adeniinin, guaniinin ja sytosiinin (yllä) emäksen (yllä) välillä (yllä).
Näiden typpipohjaparien väliset molekyyliset vety sillat tekevät DNA -molekyylistä hankkimaan kaksoispotkurirakenteen, joka on ihanteellinen sen replikaatioon. Jos nämä vety sillat rikkoutuvat kuumentamalla, kaksoispotkuri lopulta avautuu kahdella yksittäisellä segmentillä tai nauhalla.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Edward E. Ávila ja asilé j. Karhunvatukka. (2004). Vety -silta ja sen sovellukset linkittävät. Los Andien yliopisto, tiedekunta, kemian laitos.
- Wikipedia. (2020). Vetysidos. Haettu: vuonna.Wikipedia.org
- Pietri J. & Clark J. (21. elokuuta 2020). Vedyn sidos. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Enyclopaedia Britannica -toimittajat. (2020). Vedyn sidos. Toipunut: Britannica.com
- Helmestine, Anne Marie, PH.D -d. (29. lokakuuta 2020). Mitkä ovat esimerkki vedyn sidoksesta? Toipunut: Admingco.com

