Kaliumbromidirakenne (KBR), ominaisuudet, käyttötarkoitukset
- 3923
- 521
- Ronald Reilly
Hän kaliumbromidi Se on epäorgaaninen suola, jonka kemiallinen kaava on kbr. Sen muodostuu bromidianionin sähköstaattisessa liitossa, BR-, Ja kaliumkation, k+, 1: 1 -suhteessa; eli meillä on sama määrä BR: tä- K: n alkaessa+ KBR -kiteissä.
Kaliumbromidi on kiinteä valkoinen tai kiteinen suola, se on hajuton, erittäin liukeneminen veteen ja vähän liukenee etanoliin ja etanoliin. Sitä käytettiin 1800 -luvun viimeisellä osalla ja suuren osan 2000 -luvusta epilepsian hoidossa ja sedatiivisena.
Vuoteen 1975 saakka se jatkoi vapaasti myymistä, vuosi, jolloin sen käyttö väheni potilaille tuottamien myrkyllisten vaikutusten takia. Tällä hetkellä sitä käytetään edelleen useissa eläinlajeissa kouristusten hoidossa, vaikka vuodesta 1912 se korvattiin natriumfenobarbitaalilla.
Kaliumbromidia käytetään optisissa tutkimuksissa, jotka vastaavat sähkömagneettisen spektrin läheistä infrapuna -aluetta. Se toimii myös valokuvauksen alalla käytettynä materiaalina.
[TOC]
Linkkityyppi
Kaliumbromidi on binaarinen suola, bromiatomin yhdistelmän tuote hapetustilassa -1, kaliumiatomilla hapettumistila +1. Siksi ionin BR: n välinen sähköinen vetovoima on muodostettu- Ja K -ioni+.
Tämän tyyppinen sähkö- tai sähköstaattinen vuorovaikutus tunnetaan ionisena sidoksena, joka dissosioituu, kun kaliumbromidisuola liukenee veteen, vapauttaen k -ionit+ ja br-.
Vedenomistajat hajottavat nämä ionit.
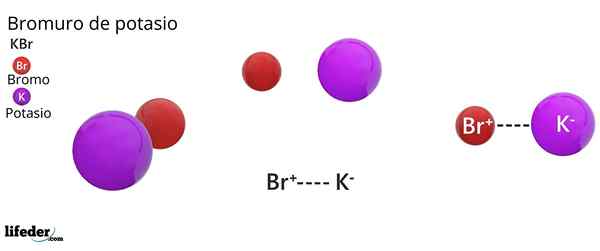
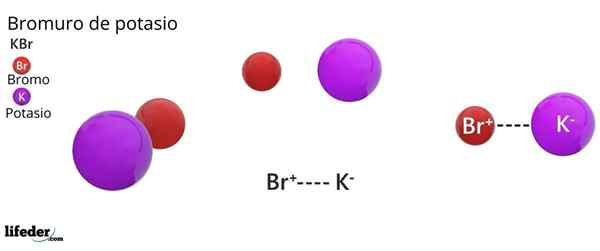
Kaliumbromidirakenne
 KBR: n kiderakenne FCC: Ruskeat pallot vastaavat BR-arvoa, kun taas violetti pallot vastaavat kationeja k+
KBR: n kiderakenne FCC: Ruskeat pallot vastaavat BR-arvoa, kun taas violetti pallot vastaavat kationeja k+ Kaliumbromidi esittelee kuutiomaisen kiteisen rakenteen, joka on keskitetty kasvoihin (FCC) Kasvojenkeskeiset kuutiometriä), yhtä suuri kuin natriumkloridissa havaittu.
Voi palvella sinua: Faraday ConstantTässä rakenteessa jokainen anion br- Se on linkitetty tai koordinoitu kuuden kationin kanssa+, Ja puolestaan jokainen k+ Siinä on kuusi BR: tä- Naapureina kiteisissä verkoissa.
Nimikkeistö
Kaliumbromidi luokitellaan halogenidiksi tai alkalimetalliksi halogeenidiksi. Näiden suolojen nimet on rakennettu poistamalla halogeenin nimen lopullinen kirjain (kloori, bromi, jodi, fluori ja astato), fluoria lukuun ottamatta ja korvaamalla lopullinen kirjain jälkiliitteellä -RO: lla. Metallin nimi on kirjoitettu alla ilman muutoksia.
Esimerkiksi: natriumkloridi, kaliumjodidi, kalsiumfluori jne. Siksi KBR: tä kutsutaan kaliumbromidiksi tai kaliumbromidiksi (perinteisen nimikkeistön mukaan).
Kaliumbromidiominaisuudet
 Kellolevy KBR -rakeilla. Lähde: Walkerma Wikipedian kautta.
Kellolevy KBR -rakeilla. Lähde: Walkerma Wikipedian kautta. Fyysinen ulkonäkö
Väritön lasi, kiteinen tai valkoinen rake.
Haju
Käymälö
Maku
Korkealla pitoisuudella sillä on katkera ja mausteinen maku.
Moolimassa
119.02 g/mol
Tiheys
2.74 g/cm3 25 ºC: lla
Sulamispiste
734 ºC
Kiehumispiste
1435 ºC
Vesiliukoisuus
535 g/l A 0 ºC
678 g/l a 25 ºC
1020 g/l 100 ºC
1 gramma suolaa liuotetaan 1 ml kiehuvaa vettä, mikä osoittaa, että se on hyvin liukoinen veteen.
Liukoisuus glyseroliin
217 g/l
1 gramma kaliumbromidia liukenee 4.6 ml glyserolia.
Etanoliliukoisuus
47.6 g/l a 80 ºC.
1 gramma kaliumbromidia liukenee 250 ml: aan etanolia.
Höyryn tiheys
7.14 Yksikkönä otettu ilmarauhassa.
Vakaus
Vakaa, jos sitä tallennetaan suositelluissa olosuhteissa. Yhteensopimattomia hapettavien aineiden, vahvojen happojen, bromitrifluoridin ja bromin kanssa.
Hajoaminen
Hajoamiseen kuumennettuna säteilee haitallisia tuotteita, kuten vetybromidia ja kaliumoksidia.
Voi palvella sinua: Ytimen elektroninen kokoonpano: Rakentaminen, esimerkitTaitekerroin (ND)
1.559
PHE
Vesiliuoksessa tuottaa neutraalin pH: n, noin 7.
sytytyspiste
1435 ºC
Liukeneminen ja reaktiivisuus
Vesipitoisessa liuoksessa KBR on täysin dissosioitunut aiheuttamaan neutraali pH -liuos.
Suola on bromidilähde, jota voidaan käyttää hopeabromidituotannossa, AGBR, valokuvien kehittämisessä käytetty yhdiste:
Kbr (ac) +agno3 (Ac) → agbr (s) +kno3 (AC)
Myös KBR on heikko pelkistävä aine, yhteensopimaton elohopea- ja hopeasuolojen kanssa. Tuottaa väkivaltaisen reaktion bromitrifluoridin kanssa. Voi reagoida monien suolojen, alkaloidien ja tärkkelyksen kanssa.
Se reagoi myös happojen kanssa, esimerkiksi konsentroituneella rikkihapolla, vapauttaen vetybromidia.
Sovellukset
Epilepsia ja kohtaushoito
Sir Charles Locock paljasti ensin kaliumbromidin kouristusten kouristuksen ominaisuudet Royal Medicine and Chirurgical Society -tapaamisessa vuonna 1857, joka edisti sen käyttöä epilepsian hoidossa.
Kaliumbromidia käytettiin ensisijaisena lääkityksenä epilepsian hoidossa ja sedatiivisena vuoteen 1912, jolloin natriumfenobarbitaali ilmoitettiin.
Silti sitä käytettiin edelleen komplementtina natriumfenobarbitaalille epilepsian kouristusten käsittelyssä.
Vuonna 1975 sen myrkyllisen luonteen vuoksi FDA U.S. (Elintarvike- ja lääkehallinto) päätti olla suosittelematta kaliumbromidin käyttöä, sekä ihmisissä että eläimissä. Jotkut maat kuitenkin jatkoivat sen hallintaa.
Kaliumbromidia käytettiin hypnoottisena ja rauhoittavana nautakarjassa, hevosissa, lampaissa ja sikoissa. Sitä käytettiin myös hevosten koliikin ja tetanian hoidossa ja kouristusten hoidossa koirilla.
Infrapunaoptiikka
Kaliumbromidin läpinäkyvyyden johtuen ultraviolettivalon ja lähellä olevan infrapuna -aallonpituuksien alueella, sitä käytetään ikkunoiden komponenttina useille sähkömagneettiselle säteilylle, erityisesti infrapunasäteilylle.
Voi palvella sinua: osmolaarisuusTässä suhteessa käytetään useita tekniikoita. Yksi heistä koostuu kahden kaliumbromidin kiteisen levyn laatimisesta, asettamalla kalvon materiaalista, joka analysoidaan albumeihin infrapuna. Tutkimukset suoritetaan lähes infrapunassa välillä 780 nm - 3000 nm.
Valokuvaus
 KBR oli osa materiaaleja, joita käytettiin kahdennenkymmenennen vuosisadan ensimmäisten valokuvien käsittelemiseen
KBR oli osa materiaaleja, joita käytettiin kahdennenkymmenennen vuosisadan ensimmäisten valokuvien käsittelemiseen Kaliumbromidilla on ollut lukuisia käyttötarkoituksia ja sovelluksia valokuvauksessa, esimerkiksi: sitä on käytetty valokuvauskehittäjien muotoiluun, valokuvaelokuvien valmistuksessa, elokuvan paksuus ja värivalkaisuaineessa värillisinä.
Sitä käytetään altistuneiden hopeahalogenidikiteiden erilaistumisen parantamisessa, jotka eivät ole alttiina, ohuiden negatiivien tulostustiheyden lisääntyessä ja sekundaarisena halogenidina yhdessä jodidien kanssa negatiivisen paperin prosessointiin paperilla.
Sitä on käytetty myös yhdessä elohopeabikloridin, kuparisulfaatin tai kaliumferriciaurion kanssa valokuvien valkaisuaineissa. Se on toiminut myös rajoittajana gelatiinilevyihin ja kehityspapereihin käytettyjen alkalisten kehittäjien rajat.
Kemiallinen analyysi
KBR: tä käytetään kuparin ja hopean arvioinnin määrittämisessä intialaisen, kadmiumin ja arseenin polarografisessa analyysissä.
Muut käyttötarkoitukset
Sitä käytetään litografian kaiverrusprosesseissa, öljynkäsittelyssä, nylonin lämpövakautuksessa, kuitujen valmistuksessa ja lopulta erityisten saippuiden valmistuksessa.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Päivä, r., & Underwood, a. (1986). Kvantitatiivinen analyyttinen kemia (Viides ed.-A. Pearson Prentice Hall.
- Wikipedia. (2020). Kaliumbromidi. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2021). Kaliumbromidi. Pubchem Comunund -yhteenveto CID 253877: lle. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- EMEA. (1999). Bromidi, kaliumsuola: Yhteenvetoraportti. [PDF]. Toipunut: EMA.Eurooppa.EU
- Sevier b.V. (2020). Kaliumbromidi. Tiede. Haettu: ScienEdirect.com

