Itiöiden värjäys
- 2267
- 595
- Ronald Reilly
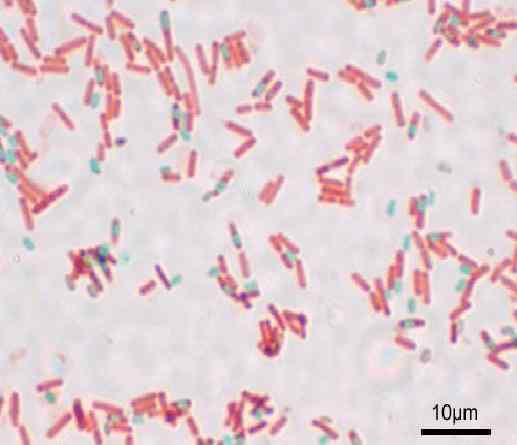
 Itiöiden värjäys Shaeffer-Fulton tai Wirtz-Conklin -menetelmä. Lähde: Y myös (alkuperäinen lataus) [GFDL (http: // www.GNU.Org/copyleft/fdl.html) tai cc-be-sa-3.0, Wikimedia Commons
Itiöiden värjäys Shaeffer-Fulton tai Wirtz-Conklin -menetelmä. Lähde: Y myös (alkuperäinen lataus) [GFDL (http: // www.GNU.Org/copyleft/fdl.html) tai cc-be-sa-3.0, Wikimedia Commons Mikä on itiöiden värjäys?
Se Itiöiden värjäys Jotkin bakteerien suvut muodostavat metodologian, kun ne ovat epäedullisissa olosuhteissa. Se palvelee bakteerien tunnistamista.
Itiöitä muodostavat monet tyylilajit, mutta tärkeimmät ovat Basilli ja Clostridium. Näitä tyylilajeja pidetään merkityksellisempinä, koska niillä on patogeenisiä lajeja ihmiselle.
Jokainen bacillus voi aiheuttaa itiötä. Valmistuksen värjäytymishetkellä itiö löytyy Bacilluksen (endosporan) tai tämän ulkopuolelta (Exospora). Tavanomaisten väritystekniikoilla bakteereille - kuten gramman värjäys - itiöt ovat värittömiä.
Tällä hetkellä on useita väritysmenetelmiä, jotka kykenevät ylittämään itiön paksun rakenteen sen värjätäkseen. Nämä menetelmät ovat hyvin monipuolisia, ja Dornerin tekniikka, Möellerin värjäys ja Shaeffer-Fulton-metodologia, joka tunnetaan myös nimellä Wirtz-Conklin.
Kaikista mainituista tekniikoista Shaeffer-Fultonin metodologia on eniten käytetty rutiinilaboratorioissa. Velkaa nimensä kahdelle mikrobiologille, jotka loivat värin vuonna 1930: Alicia Shaeffer ja MacDonald Fulton. Joskus tekniikkaa kutsutaan kuitenkin Wirtz-Conkliniksi kahden 1900 bakteriologin kunniaksi.
Perusta
Itiöt eivät ole värjätty tavanomaisilla väreillä, koska niillä on erittäin paksu seinä. Itiöiden kompleksi koostumus estää useimpien väriaineiden pääsyn.
Jos ulkopuolen itiö tutkitaan sisäänpäin, havaitaan seuraavia kerroksia: Ensinnäkin on eksosporium, joka on hieno ja ulkoisin kerros, jonka muodostaa glykoproteiinit.
Sitten tulee kynsinauha, joka tarjoaa vastustuskyvyn korkeille lämpötiloille, mitä seuraa peptidoglykaani koostettu aivokuori. Myöhemmin on pohja, joka suojaa protoplastiä.
Itiö on kuivunut rakenne, joka sisältää 15% kalsiumia ja dipycoliinihappoa. Siksi suurin osa itiöiden väritekniikasta perustuu lämmön levitykseen, jotta väriaine voi tunkeutua paksuun rakenteeseen.
Voi palvella sinua: Laktogeneesi: Ominaisuudet ja vaiheetKun itiö on värjätty, se ei voi poistaa väriainetta. Shaeffer-Fulton-tekniikassa Malachite's Green tulee vegetatiivisiin soluihin ja levittämällä lämpöä tunkeutuu endosporaan.
Veellä pesemällä väriaine poistetaan vegetatiivisesta solusta. Tämä tapahtuu siksi, että Malachite -vihreä väriaine on hiukan emäksistä, joten vegetatiivinen solu sitoutuu heikosti.
Sen sijaan et pääse itiöön ja lopulta bacillus safraniinilla on palkattu. Tämä perusta on pätevä muille tekniikoille, joissa tapahtuu jotain vastaavaa.
Itiöiden väritystekniikat
Itiöiden värjäyksen suorittamiseksi sinulla on oltava puhdas sato epäilyttävästä kannasta, jota haluat opiskella.
Satolle altistetaan äärimmäiset lämpötilat 24 tunnin ajan mikro -organismin stimuloimiseksi satunnaisesti. Tätä varten sato voidaan sijoittaa 44 ° C: seen tai jääkaappiin (8 ° C) 24 tai 48 tunnin ajan.
Jos jätät liian kauan edellä mainituissa lämpötiloissa, havaitaan vain exosurureita, koska kaikki endosporit ovat poistuneet Bacilluksesta.
Huipentunut aika, muutama tippa steriilistä fysiologista liuosta puhtaaseen liukuun tulisi sijoittaa. Sitten otetaan pieni osa sadosta ja pidennetty sakko.
Myöhemmin sen sallitaan kuivua, se kiinnitetään lämmöön ja väriaineen joihinkin alla selitetyistä tekniikoista:
Dorner -tekniikka
- Valmista koeputkessa tislatussa vedessä nousevan mikro -organismin väkevöity suspensio ja lisää yhtä suuren määrän fenicada fuchsinaa Kinyounissa suodatettu.
- Aseta putki kylpyyn kiehuvalla vedellä 5–10 minuutin ajan.
- Sekoitettuna puhtaalla liukumäki sekoitti tippa edellinen jousitus pisara vesipitoista nigrosiiniliuosta 10%: lla, keitetty ja suodatettu.
- Laajentaa ja kuivaa pehmeällä lämmöllä.
- Tutki 100x: n tavoitteella (upotus).
Itiöt ovat värjätty punaisina ja bakteerisolut näyttävät melkein värittömältä tummanharmaata vastaan.
Voi palvella sinua: Helmintologia: Alkuperä, mitä tutkimuksia, esimerkki tutkimuksestaMuokattu Dorner -tekniikka
- Laajennettu stipensio stifioidusta mikro -organismista tehdään liukumäelle ja kiinnitetään lämmölle.
- Näyte on peitetty suodatinpaperinauhalla, johon lisätään Fenicada Fuchsiin. Väriaine lämmitetään 5-7 minuuttia Bunsen -vaalealla liekillä, kunnes höyryn irrottaminen luodaan. Sitten paperi vedetään.
- Valmistus vedellä pestään ja kuivuu sitten imukykyisellä paperilla.
- Stola on peitetty ohuella 10%: n nigrosiinin elokuvalla, joka käyttää toista dioa nigrosiinin tai neulan laajentamiseen.
Itiöiden ja bakteerien ottama väri on yhtä suuri kuin edellisessä tekniikassa kuvailtu.
Shaeffer-Fulton tai Wirtz-Conklin -tekniikka
- Tee pidennetty sakko stipensio stifioidusta mikro -organismista liukussa ja kiinnitä lämpö.
- Peitä liuku vesipitoisella vihreällä malakiitliuoksella 5%: lla (suodatinpaperi voidaan asettaa arkkiin).
- Kuumenna Bunsenin vaalealla liekillä, kunnes se aiheuttaa höyryn irrottautumista ja poista liekki. Toista toiminta 6-10 minuuttia. Jos menettelyn aikana malakiitin vihreä liuos haihtuu, enemmän voidaan lisätä.
- Irrota suodatinpaperi (jos se on asetettu) ja pese vedellä.
- Peitä liuku 0,5% vesipitoisella safraniinilla 30 sekunnin ajan (jotkut tekniikan variantit käyttävät 0,1% vesipitoista safraniinia ja jätä se 3 minuutiksi).
Tällä tekniikalla itiöt esitetään vihreinä ja punaiset bakteerit.
Sillä on haittaa, että nuorten viljelykasvien endosporit eivät ole värjätty hyvin, koska ne näyttävät erittäin selkeiltä tai värittömiltä. Tämän välttämiseksi on suositeltavaa käyttää 48 tunnin inkubaatiokasveja.
Möeller -tekniikka
- Peitä sade kloroformilla 2 minuutin ajan.
- Hävitä kloroformi.
- Peitä 5 -prosenttisella kromihapolla 5 minuutin ajan.
- Pese tislatulla vedellä.
- Fuchsin-fenicada-karbolin arkki peitetään ja altistetaan Bunsen-sytyttimen liekkille höyryjen päästöön, sitten se poistetaan liekistä hetken hetken. Operaatio toistetaan 10 minuuttiin asti.
- Pestä vedellä.
- Käytä happaita etanolia (suolaklojas alkoholi) värjäytymiseen. Se on jätetty 20 tai 30 sekuntia.
- Pese tislatulla vedellä.
- Palkkaa peittää arkki metyleenisinisellä 5 minuutin ajan.
- Pese tislatulla vedellä.
- Sen annetaan kuivua ja viedä näyte mikroskooppiin.
Itiöt näyttävät punaisilta ja sinisiltä bakteereilta. On tärkeää olla pyrkimättä höyryihin, koska ne ovat myrkyllisiä ja pitkällä aikavälillä ne voivat olla syöpää aiheuttavia.
Möeller -tekniikka, joka on muokattu ilman lämpöä
Vuonna 2007 Hayama ja hänen yhteistyökumppaninsa loivat muutoksen Möellerin tekniikasta. Ne eliminoivat väriaineen värityksen ja korvasivat sen lisäämällä 2 tippaa pinta-aktiivista tergitolia 7 jokaista 10 ml Fuchsiin-muotoillun karboliliuosta,. Samat tulokset saatiin.
Sovellukset
Itiöiden väri tarjoaa erittäin arvokasta ja hyödyllistä tietoa patogeenin tunnistamiselle, koska saman, sen muoto, sijainti Bacilluksessa ja kyky muodostaa vegetatiivinen solu vai ei, ovat tietoja, jotka voivat ohjata lajeja päällä lajit, jotka ovat mukana tiettyyn sukupuoleen.
Tässä yhteydessä on syytä sanoa, että itiöt voivat olla pyöreitä tai soikeita, ne voivat sijaita keskustassa tai myös palacentral-, ala- tai terminaalisessa asennossa.
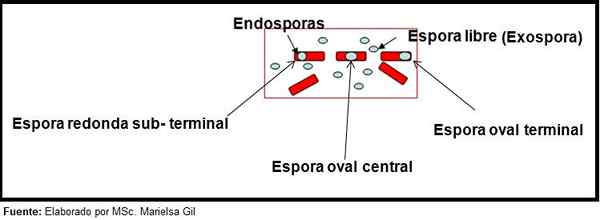 Endosporien ja Exposorin muodon ja sijainnin kaavio
Endosporien ja Exposorin muodon ja sijainnin kaavio Esimerkit
- Clostridium difficile Se muodostaa soikean itiön terminaalissa, joka muodonmuutos bacillus.
- Itiö Clostridium Tertium Se on soikea, ei muodostu bacillusta ja sijaitsee terminaalitasolla.
- Endospora Clostridium tetani Se on päätelaite ja muodostaa Bacilluksen, mikä antaa rumpukepän ulkonäön.
- Itiöt Clostridium botuliini, C. histolyticum, C. Hölynpöly ja C. septiki Ne ovat pyöreitä tai soikeita, maan alla.
- Endospora Clostridium Sordelli Se sijaitsee keskusasennossa, pienellä muodonmuutoksella.
Viitteet
- Moeller -tahra. Haettu jstk.Wikipedia.org.
- Endospora. ES: stä palautettu.Wikipedia.org.
- Forbes, b., Sahm, D., Weissfeld, a. Bailey & Scott -mikrobiologinen diagnoosi. Pan -American toimitus.-Lla.

