Grammavärjäys
- 4500
- 830
- Mr. Clifford Kshlerin
 Gram -värjäys on hyödyllinen erityyppisten bakteerien visualisoinnissa
Gram -värjäys on hyödyllinen erityyppisten bakteerien visualisoinnissa Mikä on Gramin värjäys?
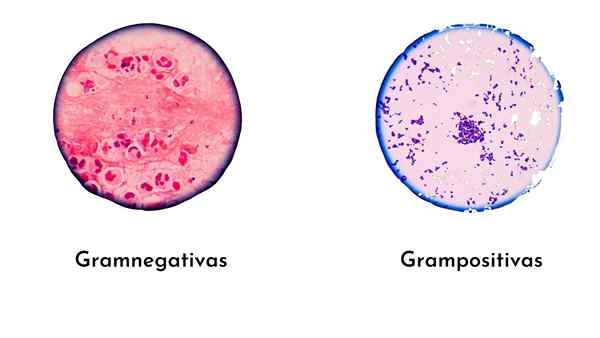
Se Grammavärjäys Se on yksinkertaisin ja hyödyllisin väritystekniikka diagnostisessa mikrobiologiassa bakteerien tunnistamiseksi. Tämän tekniikan on luonut Tanskan lääkäri Christian Gram vuonna 1884, joka luokitteli bakteerit grampositiivisiin (violetti) ja gram -negatiivisiin (vaaleanpunaisiin) soluseinämän koostumuksen mukaan.
Tekniikka kärsi tiettyjen Huckerin muutoksista vuonna 1921 reagenssien stabiloimiseksi ja värjäytymisen laadun parantamiseksi, joten Gramin värjäys tunnetaan myös nimellä Gram-Hucker.
Tämän tekniikan avulla se on myös mahdollista. Samoin kuin sen jakautuminen avaruudessa: klusterissa, ketjussa, eristetty, pareittain, tetradeissa jne.
Perusta
Se on tekniikka, joka esittelee 4 perustavanlaatuista vaihetta: värjäytyminen, korjaaminen peite-, värimuutoksella ja vuokraamisella. Siksi väritysbakteerien lisäksi se antaa sinun myös erottaa ne.
Violetti kristalli on ensimmäinen käytetty väriaine. Samalla on affiniteetti peptidoglykaania kohtaan ja värjäävät kaikki läsnä olevat bakteerit, jotka myöhemmin sijoittivat lugolin, joka toimii masentumattomana, ts. Se indusoi liukenemattomien violetti lasin/jodin/ribonukleaaristen proteiinien muodostumisen solun sisällä.
Gram -positiiviset bakteerit, joilla on paksu peptidoglykaaniseinä, muodostavat monimutkaisempia (violetti/jodilasi), siksi ne värjätään violetiksi.
Se vaikuttaa myös siihen, että gram -positiivisten bakteerien seinämä sisältää enemmän turvattomia hapoja, jotka osoittavat suurta affiniteettia hapettaviin aineisiin (Lugol).
Gram -negatiivisilla bakteereilla on ohut peptidoglykaani, mikä tekee bakteereista vähemmän monimutkaisia kuin grampositiivinen.
Myöhemmin tulee värimuutoksen vaihe, jossa gram -positiiviset ja gram -negatiiviset bakteerit käyttäytyvät eri tavalla.
Gram -negatiiviset bakteerit sisältävät lipopolysakkaridien runsaasti ulkomembraania, joka on osa sen soluseinämää. Rasvat tuhoutuvat kosketuksella asetonialkoholin kanssa, joten ulkoinen kalvo on epävakautta, violetti lasi vapautuu.
Näin se palkataan myöhemmin safraniinin tai fuchsiinin kanssa, ottaen punaisen värin.
Gram -positiivisten bakteerien tapauksessa ne kestävät värimuutoksia, koska valkaisuaine toimii sulkemalla huokoset, mikä estää violetti kidekompleksia/jodia pääsemästä ulos ulos.
Siksi värjäys violetti lasilla on vakaa, eikä safraniinille tai fuchsiinille ole paikkaa. Siksi nämä bakteerit ovat värjätty voimakkaasti tai violetiksi.
Materiaalit
Gramin värisarja koostuu:
- Violetti lasi.
- Lugoli.
- Asetonialkoholi.
- Perus safraniini tai fuchsiini.
Väriaineen ja reagenssien valmistelu
Violetti kristalliliuos
Ratkaisu:
Violetti kristalli - 2 gr
95% - 20 cm3 etyylialkoholi
Ratkaisu B:
Ammoniumoksalaatti - 0.8 gr
Tislattu vesi- 80 cm3
Violettin lasin lopulliseen valmistukseen liuos 1:10 on laimennettava tislatulla vedellä ja sekoitettava 4 osaa liuosta B. Seosta tallennetaan 24 tuntia ennen sen käyttöä. Se suodatetaan meripihkan värjäyspulloksi paperisuodattimella.
Se voi palvella sinua: Chiapas Flora ja Efauna: Edustavat lajitPäivittäinen käytetty määrä siirretään keltaiseen pulloon, jossa on pudottajaa.
Jodi-lugol
Punnitse ja mittaa kunkin yhdisteen osoitettu määrä seuraavasti:
Jodikiteitä - 1 gr
Kalium joduro - 2 gr
Tislattu vesi - 300 cm3
Kaliumjodidi liuotetaan vähän vähitellen veteen ja myöhemmin jodi lisätään. Liuos keltaiseen pulloon siirretään.
Päivittäinen käytetty määrä siirretään pienempään keltaiseen pulloon, jossa on pudottajaa.
Diskroinit
95% etyylialkoholi - 50 ml
Asetoni - 50 ml
Se on valmistettu yhtä suurina osissa. Peitä hyvin, koska sillä on taipumus haihtua.
Bottero futissa.
Tämä valmistelu tarjoaa kohtalaisen aikavälin 5-10 sekunnin ajan., Ja se on suositeltavin.
Aloittelijat mieluummin käyttävät vain 95%etyylialkoholia, jossa värimuutos on hitaampaa, 10-30 sekunnista.
Vaikka kokeneimmat voivat käyttää puhdasta asetonia, missä värimuutos tapahtuu erittäin nopeasti 1: stä 5 sekunnin ajan.
Kontrasti
Safraniini äidiliuos
Safraniini - 2.5 gr
95%etyylialkoholi - 100 cm3
Punnittuaan ilmoitetun määrän safraniinia, se liukenee 100 cm3: n etyylialkoholilla 95%: lla.
Äiti -liuoksesta valmistetaan työn safraniiniliuos.
Tätä varten mittaa 10 cm3 äiti -liuosta, lisää 90 cm3 tislattua vettä 100 ml: n loppuun saattamiseksi.
On suositeltavaa siirtää päivittäin käytetty määrä keltaiseen pulloon tippujalla.
Mikro-organismit, jotka on värjätty heikosti gram-hukkurin värjäytymisellä, tietyinä anaerobeina, Legionella SP, Campylobacter SP ja Brucella sp, Ne voidaan värjätä paljon paremmin, jos Kopeloffin tekemä modifikaatio gramma-ohjaajan värjäytymiseen, nimeltään Gram-Kopeloff-värjäys.
Tämä tekniikka muuttaa safraniiniväriainetta perusfuchsiinille. Tällä muutoksella on mahdollista värittää tehokkaasti edellä mainitut mikro -organismit.
Reagenssin varastointi
Valmistetut väriaineet on säilytettävä huoneenlämpötilassa.
Laajennetun näytteen valmistus väritykseen
Näytteen on oltava vähintään 105 Mikro -organismit ennen sen tarkkailua on todennäköisesti levitys. Laajennettuja voidaan suorittaa suorasta näytteestä tai viljelykasveista kiinteissä tai nestemäisissä väliaineissa.
Laajennettujen on oltava yhtenäisiä, hyvin jakautuneita eikä kovin paksuja läsnä olevien rakenteiden paremman visualisoinnin saavuttamiseksi.
Gramma suoria näytteitä
Grammaa virtsaa ilman sentrifugointia
Virtsa on sekoitettu ja 10 ui asetetaan liukumäelle. Ainakin yhden bakteerin/upotuskentän havaitseminen osoittaa, että infektiota on.
Tämä tarkoittaa, että sato on noin 100.000 UFC/ml (105 Virtsan ufc/ml) 85%: lla tapauksista.
Tämä menetelmä ei ole hyödyllinen siirtomaa -arvoissa alle 100.000 UFC.
Gramma CSF
CSF: n tulisi olla sentrifug, supernatantti poistetaan ja sedimentti ulottuu liukumäkeen. Tämä neste on steriili normaaleissa olosuhteissa. Bakteerien havainto osoittaa infektiota.
Voi palvella sinua: suolalaskejaGramma hengitysnäytteitä
Yskö Gram, keuhkoputken tai bronkoalveolaarinen pesu, vaikka mikro -organismeja voi olla erilaisia, se ohjaa diagnoosia aina hyödyllisenä havaitun solutyypin lisäksi.
ESPUTO: n tapauksessa pidennetty näytteen märkivimmät osat on valmistettava.
Uloste gramma
Ei ole suositeltavaa tehdä grammaa tämän tyyppisille näytteille, koska sillä ei ole diagnoosiarvoa.
Gramma sato
Ne voidaan tehdä kahdella tavalla, yksi nestemäisistä viljelykasveista ja toinen kiinteistä viljelykasveista.
Nestemäinen kasvi
Nestemäisistä viljelykasveista se on erittäin yksinkertainen: Vaimennettujen hämärän liemen paistissa otetaan ja asetetaan puhtaalle ja kuivalle liukumäelle, mikä antaa pyöreitä liikkeitä keskustasta reunaan, materiaalin jakamiseksi tasaisesti.
Se sallitaan spontaanisti ilmaa. Kun kuiva, materiaali kiinnitetään arkkiin lämmöllä. Tätä varten ohitat arkin 3–4 kertaa Bunsen -sytyttimen liekin läpi,.
Arkin sallitaan jäähtyä ja asetettu värisillaan.
Kiinteät viljelykasvit
Suoritaksesi laajennetun grammavärjäyksen kiinteästä sadosta, jatka seuraavasti:
Ennen kuin valitset siirtokuntia, sinun on valmistettava kolikkopaikka, asettamalla noin kaksi tippaa steriiliä fysiologista suolaliuosta.
Jos alkuperäinen viljelylevy sisältää useita erilaisia pesäkkeitä, kunkin eristetty pesäke valitaan gramman suorittamiseksi. Jokainen pesäke otetaan platinakahvan kanssa liuottaaksesi sen aiemmin liukeneelle suolaliuokseen.
Pyöreät liikkeet annetaan keskustasta reuna -alueelle, jotta siirtomaa levitetään liukussa homogeenisesti.
Se sallitaan spontaanisti ilmaa. Kuivaa, arkki kiinnitetään lämmöllä, kuten edellä selitetään (aukkopaikan palauttaminen kevyemmällä), huolehtiminen siitä, ettei materiaalia polttaa materiaalia.
Tämä toimenpide on suoritettava jokaisen erityyppisen pesäkkeen kanssa. Esimerkiksi havaitun järjestys:
Colonia 1: Klustereissa havaittiin beetahemolyyttinen keltainen kolonia: grampositiivisia kookospähkinöitä.
Colonia 2: Conder Colonia, ilman hemolyysiä: gramnegatiivisia kokobacillia havaittiin.
Jokainen arkki on leimattu tietämään, mitä tarkkailemme.
Tekniikka
Gramin väritekniikka on erittäin helppo suorittaa ja suhteellisen taloudellinen, eikä se voi puuttua mikrobiologian laboratoriosta.
Se tehdään seuraavasti:
- Aseta levitys lämmöllä ja paikka värisillassa.
- Arkki on täysin peitetty violetti lasilla 1 minuutti.
- Pestä vedellä. Älä kuivaa.
- Peitä arkki Lugol -liuoksella, anna toimia minuutin ajan. Pestä vedellä. Älä kuivaa.
- Koristele 5-10 sekuntia pehmeällä levottomuudella asetonialkoholissa. O Aseta arkki pystysuunnassa ja pudota pinta -arvon purkautuvat pisarat, kunnes se vetää violettikristallia. Älä ylitä.
- Pestä vedellä. Älä kuivaa.
- Aseta arkki värisiltaan ja peitä 30 sekunnilla safraniinilla (gram-hukkari) tai 1 minuutin Fuchsinan (Gram-Kopeloff) kanssa (Gram-Kopeloff).
- Pestä vedellä.
- Päästä spontaanisti ilmassa pystysuorassa asennossa.
Kun olet kuiva, aseta 1 tippa upotusöljyä tarkkailemaan sitä 100x: n kohteen alla optisessa mikroskoopissa.
Gram -värjäytymisen käyttö/sovellukset
- Tämä tekniikka mahdollistaa useimpien bakteerien morfotiantoriaaliset erot.
- Hiivat erottuvat myös tällä värillä. He ottavat violetti lasin, ts. He ovat värjätty grampositiivisesti.
- Voit erottaa grampositiiviset itiöt bacillit, joissa Bacilluksessa havaitaan kirkas tila, jossa endospora muodostettiin, vaikka itiöt eivät ole hyvin värjättyjä. Itiöiden väriaineeseen käytetään muita tekniikoita, kuten Shaeffer-Fulton.
- Auttaa määrittämään antibiootin tyypin, joka on valmistettava.
On huomattava, että tämä värjäys Se ei toimi Kaikentyyppisten bakteerien väritys, ts. On tapauksia, joissa värjäys ei toimi.
Näissä tapauksissa voidaan mainita bakteerit, joista puuttuu soluseinämä. Esimerkiksi: sukupuoli Mycoplasma, sferoplasti, Ureaplasma, L muodot ja protoplastit.
Lisäksi bakteerit, joissa on bakteereja, rikkaat mykolihapot, kuten mykobakteerit, ja solunsisäiset bakteerit, kuten klamydias ja rickettsias.
Se on myös tehotonta värjätä useimmat spirokemialliset bakteerit.
Samassa suvussa on bakteereja, joita voidaan havaita samassa näytteessä kuin grampositiivinen ja gram -negatiivinen. Kun tämä tapahtuu, sitä kutsutaan muuttuvan grammaväriksi, joka voi johtua ravinteiden, lämpötilan, pH: n tai elektrolyyttipitoisuuden muutoksesta.
Yleiset virheet
Koristeta liioiteltua
Värmekulutuksen liioitelu voi aiheuttaa väärien gram -negatiivisten mikro -organismien havaitsemisen.
Älä odota tarpeeksi kuivausaikaa upotusöljyn lisäämiseen
Tämä virhe aiheuttaa rasvan miselien muodostumisen, joka estää läsnä olevien rakenteiden havaintoa. Tämä tapahtuu, kun öljy liittyy hajuun läsnä oleviin vesimolekyyleihin.
Sijoita reagenssijärjestys
Tällainen virhe tuottaa gram -negatiivisia bakteereja visualisoimia, toisin sanoen vääriä gram -positiivisia.
Käytä vanhoja viljelykasveja (kiinteitä aineita tai nesteitä)
Se voi aiheuttaa grampositiivisia bakteereja värjäytymään gram -negatiivisesti (gram -negatiivinen väärä). Tämä tapahtuu, koska vanhoissa viljelykasveissa on todennäköistä, että kuolleita tai huonontuneita bakteereja on, ja näissä olosuhteissa bakteerit eivät säilytä violetti lasia.
Käytä hyvin vanhaa Lugol -liuosta
Ajan myötä Lugol menettää ominaisuutensa ja väri on haalistumassa. Jos käytetään jo rappeutuneita reagensseja, tämä ei kiinnitä violetti lasikaivoa, joten on mahdollista saada visualisointi virheellisesti gram -negatiivisista mikro -organismeista.
Sininen tausta
Oikein värjätty tausta on punainen. Sininen tausta osoittaa, että värjäytyminen oli riittämätöntä.
Viitteet
- Talot rincón, g. (1994). Yleinen mykologia. Venezuelan keskusyliopisto.
- Grammavärjäys. Otettu siitä.Wikipedia.org.
- González, M., González, n. (2011). Lääketieteellinen mikrobiologian käsikirja. Media- ja julkaisut Carabobon yliopiston osasto.

