Tyrosiiniominaisuudet, rakenne, toiminnot, edut
- 1589
- 457
- Juan Breitenberg V
Se Tyrosiini (Tyr, Y) on yksi 22 aminohapposta, jotka muodostavat kaikkien elävien olennoissa läsnä olevien solujen proteiinit. Toisin kuin muut aminohapot, kuten Valine, Troonine, Tryptophan, Leusiini, Lysiini ja muut, tyrosiini on "ehdollisesti" olennaisesti välttämätön aminohappo.
Nimi "tyrosiini" johtuu kreikkalaisesta sanasta "ammunta", mikä tarkoittaa juustoa, koska tämä aminohappo löydettiin ensin tässä ruoassa. Termi loi vuonna 1846 Liebig, joka sekoitti juustoa kaliumhydroksidin kanssa ja sai tuntemattoman yhdisteen, tuskin liukenevan veteen.
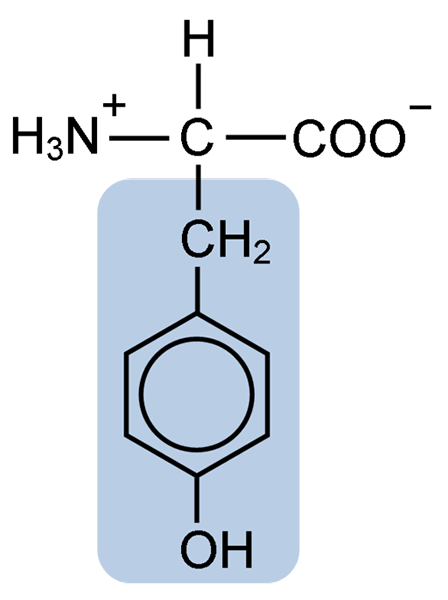
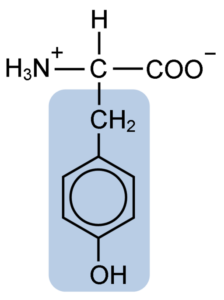 Tyrosiinin aminohapon kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Tyrosiinin aminohapon kemiallinen rakenne (lähde: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Alkuperäisen kuvauksen jälkeen muut tutkijat, kuten Warren de la Rue ja Hinterberger, saadut kookoidihyönteiset ja sarvet proteiinit, vastaavasti. Sen erottaminen muiden proteiinien hydrolyysistä suolahapolla kuvasi vuonna 1901 Mörner.
Yleensä tämä aminohappo saadaan nisäkkäiksi fenyylialaniinin hydroksylaation ansiosta, vaikka se imeytyy myös suolistossa ruoan kanssa kulutetuista proteiineista.
Tyrosiinilla on useita toimintoja ihmiskehossa, ja näiden joukossa ovat asiaankuuluvat ovat ehkä substraatin toiminnot välittäjäaineiden ja hormonien, kuten adrenaliinin ja kilpirauhashormonin, tuotannossa.
[TOC]
Ominaisuudet
Tyrosiini painaa noin 180 g/mol ja sen R- tai sivuketjuryhmä on 10 -dissosiaatiovakio 10.07. Sen suhteellinen runsaus soluproteiineissa ei ylitä 4%, mutta sillä on useita olennaisia toimintoja ihmisen fysiologialle.
Tämä aminohappo kuuluu aromaattisten aminohappojen ryhmään, jossa myös fenyylialaniini ja tryptofaani ovat. Tämän ryhmän jäsenillä on aromaattiset renkaat r r tai sivuketjuissaan, ja yleensä ne ovat hydrofobisia tai apolaarisia aminohappoja.
Kuten tryptofaani, tyrosiini absorboi ultraviolettivaloa ja on yksi aminohappojätteistä, jotka ovat vastuussa valon absorbanssista 280 nm monien proteiinien kanssa, joten se on hyödyllinen sen karakterisoinnissa.
Sitä pidetään välttämättömänä "ehdollisesti" aminohappona, koska sen biosynteesi ihmisessä riippuu fenyylialaniinista, välttämättömästä aminohaposta. Jos keho täyttää fenyylialaniinin päivittäiset vaatimukset, tyrosiini voidaan syntetisoida ilman ongelmia eikä ole rajoittava aminohappo.
Jos ruokavaliosta puuttuu fenyylialaniini, keholla ei ole vain tämän aminohapon epätasapainoa, vaan myös tyrosiinia. On myös tärkeää huomauttaa, että tyrosiinisynteesin reaktio fenyylialaniinista ei ole palautuvaa, joten tyrosiini ei pysty vastaamaan fenyylialaniinin solujen tarpeisiin.
Tyrosiini kuuluu myös aminohapporyhmään, jolla on kaksoisfunktiot tuotannossa glukogeenisten ja ketogeenisten metabolisten välittäjien tuotannossa, jotka osallistuvat aivojen glukoosin synteesiin ja ketonirunkojen muodostumiseen maksassa.
Rakenne
Kuten muutkin aminohapot, tyrosiini tai β-parahydroksifenyyli-a-amino-propionihappo, se on α-aminohappo, jolla on keskushiiliatomi, nimeltään hiili a ja joka on kiraalinen, koska se on kytketty neljä erilaista substituenttiatomia tai molekyylejä.
Tämä quiral -hiili on kytketty kahteen aminohappojen ominaisryhmään: aminohuryhmä (NH2) ja karboksyyliryhmä (COOH). Hän jakaa myös yhden sidoksistaan vetyatomilla ja jäljellä oleva sidos on kunkin aminohapon R tai sivuketju.
Tyrosiinin tapauksessa tämä ryhmä koostuu aromaattisesta renkaasta, joka liittyy hydroksyyli (OH) -ryhmään, mikä antaa sille kyvyn muodostaa vety silloja muiden molekyylien kanssa ja joka antaa sille tärkeitä funktionaalisia ominaisuuksia tietyille entsyymeille.
Se voi palvella sinua: baroreseptoritFunktiot
Tyrosiini on perustavanlaatuinen komponentti monista proteiineista, joilla on suuri biologisten aktiivisuuksien monimuotoisuus ja toiminnot.
Ihmisillä ja muilla nisäkkäillä tämä aminohappo hyödynnetään hermo- ja munuaiskudoksissa dopamiinin, adrenaliinin ja norepinefriinin synteesiä, kolme välittäjäainetta liittyvää katekolaminergistä, jotka liittyvät erittäin tärkeään kehon toimintaan.
Se on myös välttämätöntä ultraviolettisäteilysuojaimien (UV), kuten melaniinin, synteesille; Joidenkin kipulääkkeiden, kuten endorfiinien ja antioksidanttimolekyylien, kuten E -vitamiinin.
Samoin tämä aminohappo palvelee tiramiinin, oktopamiinin ja kilpirauhashormonien synteesiä jodin organisaation kautta tygyoglobuliinin tyrosiinitähteessä.
Tiramiini on ihmiskehosta löytyvä vasoaktiivinen molekyyli ja mustekapamiini on amiinia, joka liittyy norprenaliiniin.
Kaikki nämä tyrosiinin toiminnot ovat mahdollisia siitä, että se saadaan ruokavalion proteiineista tai fenyylialaniinin hydroksyloinnista maksan kanssa mainitun aminohapon systeemisen tarjonnan pääjärjestelmänä.
Kasvien toiminnot
Tyrosiini ja jotkut niiden biosynteesin aikana syntyneistä välittäjistä ruokkivat puolustukseen erikoistuneiden metaboliittien biosynteettisiä reittejä pölyttäjien vetovoiman, sähköisen kuljetuksen ja rakenteellisen tuen suhteen.
Biosynteesi
Ihmisessä tyrosiini saadaan ruokavaliosta tai syntetisoidaan fenyylialaniinista, välttämätöntä aminohappoa yhdestä vaiheessa fenyylialaniinihydroksylaasientsymaattisen kompleksin katalysoimalla reaktiolla, reaktiolla, joka katalysoi fenyylialaniinihydroksylaasin katalysoiman reaktion kautta.
Tällä kompleksilla on oksygenaasia ja sitä esiintyy vain ihmisten tai muiden nisäkkäiden maksassa. Tyrosiinisynteesireaktio merkitsee sitten happiatomin siirtämistä asentoon puolesta fenyylialaniinin aromaattinen rengas.
Tämä reaktio tapahtuu samaan aikaan, kun vesimolekyyli muodostuu toisen molekyylin happiatomin pelkistyksen vuoksi ja pelkistävä voima vaikuttaa suoraan NADPH: n konjugoituna tetrahydropteriinimolekyylin kanssa, joka on samanlainen kuin foolihappo kuin foolihappo.
Biosynteesi kasveissa
Kasveissa tyrosiini syntetisoidaan Novo alavirtaan "Shikimato" -reitistä, joka ruokki muiden aromaattisten aminohappojen, kuten fenyylialaniinin ja tryptofaanin, muita biosynteettisiä reittejä.
Näissä organismeissa synteesi perustuu yhdisteeseen, joka tunnetaan nimellä "corismato", joka on Shikimato -reitin lopputuote ja lisäksi kaikkien aromaattisten aminohappojen, tietyn vitamiinin ja kasvihormonien yleinen edeltäjä.
Corismate muunnetaan esipuheeksi Mutasa -corismate -entsyymin katalyyttisellä vaikutuksella, ja tämä on ensimmäinen "sitoutunut" vaihe tyrosiinin ja fenyylialaniinin synteesissä kasveissa.
Ennakko muuttuu tyrosiiniksi oksidatiivisella dekarboksylaatiolla ja transaminaatiolla, joka voi tapahtua missä tahansa järjestyksessä.
Yhdessä biosynteettisessä reiteissä nämä vaiheet voidaan katalysoida spesifisillä entsyymeillä, joita kutsutaan prefenaattispesifiseksi dehydrogenaasiksi (PDH) (joka muuntaa esipuheen 4-hydroksifenyylipyfenyylipyruvaatiksi (HPP)) ja tyrosiinin aminotransferaasi (joka tuottaa tyrosiinin HPP), HPP), HPP), HPP), HPP), HPP), HPP), HPP), HPP), HPP) vastaavasti.
Toinen tyrosiinin synteesin polku esipuheesta merkitsee ennakkoluulon transaminointia ei-proteinogeeniseen aminohappoon, jota kutsutaan l-arogenaatiksi, katalysoimalla entsyymi preenate-aminotransferaasilla,.
L-arogenaatti altistetaan myöhemmin oksidatiiviselle dekarboksylaatiolle tyroksiinin muodostamiseksi, entsyymin tyrosiini-arogenaattispesifisen dehydrogenaasin ohjaaman reaktion, joka tunnetaan myös nimellä ADH.
Kasvit käyttävät ensisijaisesti arenaatin reittiä, kun taas suurin osa mikrobista syntetisoi tyrosiinia HPP: stä, joka on johdettu Predenesaatista.
Säätö
Kuten suurimmassa osassa aminohappojen biosynteettisiä reittejä, kasveilla on tiukka aromaattisten aminohappojen synteesin säätelyjärjestelmä, mukaan lukien tyrosiini.
Voi palvella sinua: herkullinen hirviö: Ominaisuudet, elinympäristö, hoito, ominaisuudetNäissä organismeissa säätely tapahtuu monilla tasoilla, koska shikimato -reittiä hallitsevat mekanismit hallitsevat myös tyrosiinin tuotantoa, reittiä, jolla on myös heidän omia säätelymekanismeja.
Tyrosiinivaatimukset ja siksi niiden biosynteesin säätelyn jäykkyys ovat kuitenkin spesifisiä jokaiselle kasvilajille.
Heikkeneminen
Tyrosiinin hajoaminen tai katabolismi johtaa fumaraatin ja asetoasetaatin muodostumiseen. Tämän reitin ensimmäinen vaihe koostuu aminohapon muuntamisesta 4-hydroksifenyylipitoisuudeksi sytosolisella entsyymillä, joka tunnetaan nimellä aminotransferaasityrosiini.
Tämä aminohappo voidaan myös transaminoida hepatosyyttien mitokondrioissa aminotransferaasin aspartaattientsyymillä, vaikka tämä entsyymi ei ole kovin tärkeä normaaleissa fysiologisissa olosuhteissa.
Tyrosiinin hajoamisen kautta voi esiintyä sukkinyyliasetoasetaatti, joka voidaan dekarboksyloida sukkinyyliasetaatiksi. Succinyyli-asetaatti on tehokkain entsyymi-estäjä, joka vastaa HEMO-ryhmän synteesistä, 5-aminolevuliinihappohappo-dehydraatista.
Adrenaliini- ja norepinefriinisynteesi
Kuten mainittiin, tyrosiini on yksi tärkeimmistä substraateista ihmisen kehon kahden erittäin tärkeän välittäjäaineen synteesille: adrenaliini ja norepinefriini.
Tätä käyttää alun perin hydroksylaasityrosiinina tunnetussa entsyymissä, joka kykenee lisäämään ylimääräisen hydroksyyliryhmän RI -tyrosiini R -ryhmän aromaattiseen renkaaseen, joka muodostaa DOPA: n tunnetun yhdisteen.
DOPA aiheuttaa dopamiinia, kun se on entsymaattisesti käsitellyt entsyymi DOPA Decboxilas.
Dopamiini muunnetaan myöhemmin noreprenaliiniksi β -oksidaasidopamiinientsyymin vaikutuksella, joka katalysoi hydroksyyliryhmän lisäämistä -CH: ksi, joka oli osa tyrosiinin ryhmää R ja joka toimi "siltana" aromaattisen renkaan välillä R -ryhmän R: n välillä. ja hiili α.
Adrenaliini on peräisin norepinefriinistä fenytanoliamiinin vaikutuksella N-Metyylitransferaasi, joka on vastuussa metyyliryhmän (-CH3) S-adenosyylimeioniiniriippuvaisesta siirrosta norepinefriinin vapaaseen aminoryhmään.
Ruoat, joissa on rikas tyrosiinia
Kuten edellä mainittiin, tyrosiini on välttämätön "ehdollisesti" aminohappo, koska se syntetisoidaan ihmiskehossa fenyylialaniinin hydroksylaatiolla, välttämätöntä aminohappoa.
Siksi, jos fenyylialaniinin saanti kattaa kehon vaativat, tyrosiini ei ole rajoittava tekijä solujen normaalissa toiminnassa. Tyrosiini on kuitenkin hankittu myös proteiineista, jotka kulutetaan päivittäisillä ruokia.
Joissakin tutkimuksissa raportoivat, että sekä tyrosiinin että fenyylialaniinin vähimmäismäärän tulisi olla 25–30 mg painoa kiloa, joten keskimääräisen ihmisen tulisi kuluttaa enemmän tai vähemmän 875 mg tyrosiinia päivässä.
Ruoat, joilla on korkeampi tyrosiinipitoisuus, ovat juusto- ja soijapapuja. Näistä ovat myös naudanliha, lammas, sianliha, kana ja kalat.
Jotkut siemenet ja pähkinät, kuten pähkinät.
Saannisi edut
Tyrosiini kulutetaan yleisesti ruokavalio- tai ravitsemuslisäaineiden muodossa, erityisesti fenyylisisetonuriana kutsutun patologian hoidossa.
Se voi palvella sinua: suhdetoimintoPäivässä kulutetun tyrosiinimäärän lisääntyminen voi parantaa oppimiseen, muistiin ja hälytystilaan liittyviä kognitiivisia toimintoja stressaavissa olosuhteissa, koska sen katabolismi liittyy adrenaliinin ja norepineneenisten välittäjäaineiden synteesiin.
Jotkut ihmiset ottavat tirosiinin rikkaat tabletit pysyäkseen valppaana päivän aikana, jos he ovat menettäneet huomattavan määrän uniaikoja.
Koska tämä aminohappo osallistuu kilpirauhashormonin muodostumiseen, sen kulutuksella voi olla positiivisia vaikutuksia systeemiseen metaboliseen säätelyyn.
Puutoshäiriöt
Albinismi ja alcaptonuria ovat kaksi tyrosiinimetaboliaan liittyvää patologiaa. Ensimmäinen tila liittyy vialliseen melaniinisynteesiin tyrosiinista ja toinen liittyy tyrosiinin hajoamisen vikoihin.
Albinismille on ominaista ihon pigmentoitumisen puute, toisin sanoen siitä, että potilailla, jotka kärsivät siitä, on valkoiset hiukset ja vaaleanpunainen iho, koska melaniini on pigmentti, joka vastaa värien tarjoamisesta näille rakenteille.
Tämä patologia liittyy melanosyyttien spesifisen tyrosinaasin puutteen kanssa, joka vastaa tyrosiinin muuntamisesta dopa-quinoniksi, välittäjäksi melaniinin synteesissä.
Alcaptonurian oireet ovat ilmeisiä liioiteltuna virtsan pigmentaationa (tumma) ja myöhäisen kehityksen niveltulehdus.
Muut aineenvaihduntapatologiat
Lisäksi on muitakin tyrosiinimetaboliaan liittyviä häiriöitä, joista joukossa on:
- Tyypin I perinnöllinen tyrosinemia: karakterisoitu progressiivinen maksan rappeutuminen ja munuaisten toimintahäiriöt
- Tyypin II tai Richner-Hanhart-oireyhtymä perinnöllinen tyrosinemia: mikä käy ilmi keratiitiksi ja monien leesioiksi jalkojen käsien ja pohjan kämmenissä
- Tyypin III tyrosinemia: joka voi olla oireettoman tai läsnä henkisinä viivästyksinä
- "Hawkinsinuria": karakterisolle lapsuuden metabolinen asidoosi ja kyvyttömyys menestyä kasvussa
Metrosiinimetaboliassa on myös muita synnynnäisiä vikoja, jotka liittyvät niiden hajoamisesta vastaavien entsyymien puutteisiin, kuten hydroksylaasityrosiiniin, jotka vastaavat tyrosiinin synteesin ensimmäisestä vaiheesta tyrosiinia.
Viitteet
- Aders Plimmer, R. (1908). Proteiinien kemiallinen perustuslaki. minä lähdin. Lontoo, Iso -Britannia: Longmans, Green ja CO.
- Chakrapani, a., Gissen, P., & McKiernan, P. (2012). Tyrosiinimetabolian häiriöt. Sisään Sisäisen aineenvaihduntahalu: Diagnoosi ja hoito (PP. 265-276).
- Kretchmer, n., Levine, s., McNamara, H., & Barnett, H. (1956). Tietyt tyrosiinimetabolian näkökohdat nuoressa. Yllyttää. Tyrosiinin hapettumisjärjestelmän kehitys ihmisen maksassa. Journal of Clinical Invesiagation, 35(10), 1089-1093.
- Du, b., Zannoni, V., Laster, L., & Seegmiller, E. (1958). Tyrosiinimetabolian vian luonne alkaptonuriassa. Biologisen kemian lehti, 230, 251-260.
- Murray, r., Taivutus, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harperin kuvitettu biokemia (28. ed.-A. McGraw-Hill Medical.
- Nelson, D. Lens., & Cox, M. M. (2009). Lehninger -biokemian periaatteet. Omega -versiot (5. ed.-A.
- Schenck, c. -Lla., & Maeda, H. -Lla. (2018). Tyrosiinin biosynteesi, aineenvaihdunta ja kasvien katabolismi. Fytokemia, 149, 82-102.
- Slominski, a., Zmijewski, M. -Lla., & Paweley, J. (2012). L-tyrosiini ja L-dihydroksifenyylialaniini melanosyyttifunktioiden hormonimaisina säätelijöinä. Pigmenttisolu- ja melanoomatutkimus, 25(1), 14-27.
- Van de, g. (2018). Terveyslinja. Haettu 16. syyskuuta 2019, www.Terveyslinja.com
- MD -verkko. (n.d -d.-A. Haettu 15. syyskuuta 2019, www.Webmd.com
- Whitbread, D. (2019). Ruokatietoni. Haettu 15. syyskuuta 2019, www.MyFoodData.com
- « Sosiaalisen avun toiminnot, tyypit, laitokset Meksikossa
- Tachtenberg -menetelmä Mikä on, esimerkkejä »

