Trietilamiinirakenne, ominaisuudet, käytöt ja riskit

- 4444
- 1231
- Ronald Reilly
Se trieethilamiini Se on orgaaninen yhdiste, tarkemmin alifaattinen amiinia, jonka kemiallinen kaava on N (CH2CH3-A3 tai verkko3. Kuten muutkin nestemäiset amiinit, se aiheuttaa hajua, joka on samanlainen kuin kalojen kanssa sekoitettu ammoniakki; Hänen höyrynsä tekevät tylsiä ja vaarallisia manipuloida tätä ainetta ilman sopivaa uuttoa tai vaatteita.
Kaavojen lisäksi se lyhennetään yleensä tälle yhdisteelle ASD: nä; Tämä voi kuitenkin aiheuttaa sekaannusta muiden amiinien, kuten trietanoliamiinin, N (Ethoh) kanssa3, tai tetraetilamonium, kvaternäärinen amina, verkko4+.
 Trietyyliamiini luuranko. Lähde: Seokset [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]
Trietyyliamiini luuranko. Lähde: Seokset [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]] Sen luuranko (ylivoimainen kuva) voidaan sanoa, että trietyyliamiini on melko samanlainen kuin ammoniakki; Vaikka toisessa on kolme vety, NH3, Ensimmäisessä on kolme etyyliryhmää, N (CH2CH3-A3. Sen synteesi alkaa nestemäisen ammoniakin käsittelystä etanolilla, esiintyy alkylointi.
Verkko3 Voit muodostaa hygroskooppisen suolan HCL: llä: trietilamiinihydrokloridi, verkko3· HCL. Tämän lisäksi hän osallistuu homogeenisena katalyyttinä estereiden ja amidasten synteesissä, joten se on välttämätön liuotin orgaanisissa laboratorioissa.
Lisäksi yhdessä muiden reagenssien kanssa se mahdollistaa primaaristen ja sekundaaristen alkoholien hapettumisen vastaavasti aldehydeihin ja ketoneihin. Kuten ammoniakki on emäs, ja siksi se voi muodostaa orgaanisia suoloja neutralointireaktioiden kautta.
[TOC]
Trietyyliamiinin rakenne
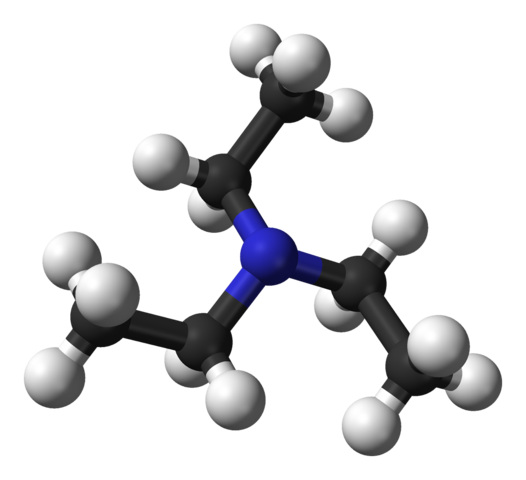 Trietyyliamiinin rakenne. Lähde: Benjah-BMM27 [julkinen alue].
Trietyyliamiinin rakenne. Lähde: Benjah-BMM27 [julkinen alue]. Yläkuva näyttää trietyyliamiinin rakenteen pallo- ja tankojen mallilla. Molekyylin keskellä typpiatomi sijaitsee, jota edustaa sinertävä pallo; Ja linkitetty häneen, kolme etyyliryhmää, kuten pienet mustan ja mustan pallon haarat.
Vaikka ne eivät ole paljaalla silmällä, typpiatomilla on pari, ei jaetut elektronit. Nämä kaksi elektronia ja kolme ryhmää -CH2CH3 He kokevat sähköisiä torjuntoja; Mutta toisaalta, ne auttavat määrittelemään molekyylin dipolimomentin.
Voi palvella sinua: sykloalcanos: ominaisuudet, reaktiot, käytöt, esimerkitTällainen dipolimomentti on kuitenkin alhaisempi kuin esimerkiksi dietyyliamiini, nhet2; Ja sillä ei ole myöskään mahdollisuutta muodostaa vety silloja.
Tämä johtuu siitä, että trietyyliamiinissa ei ole N-H-sidosta, ja näin ollen havaitaan vähäisiä fuusio- ja kiehumispisteitä verrattuna muihin amiiniin, jotka ovat vuorovaikutuksessa tällä tavalla.
Vaikka dipolimomentti on pieni, dispersiovoimia nettomolekyylien etyyliryhmien välillä ei voida sulkea pois3 naapurit. Tämän vaikutuksen lisäämällä on perusteltua miksi, vaikka trietyyliamiini on haihtuva, se kiehuu noin 89ºC, suhteellisen suuren molekyylimassansa ansiosta.
Ominaisuudet
Fyysinen ulkonäkö
Väritön neste, jolla on epämiellyttävä ammoniakin ja kalan tuoksu.
Moolimassa
101 193 g/mol.
Kiehumispiste
89ºC.
Sulamispiste
-115ºC. Huomaa, kuinka heikot molekyylien väliset voimat, jotka yhdistävät trietyyliamiinimolekyylit.
Tiheys
0,7255 g/ml.
Liukoisuus
Se on suhteellisen liukoinen veteen, 5,5 g/100 g 20ºC: ssa. PubChemin mukaan alle 18,7 ºC: n mukaan se on jopa sekoittumassa tämän kanssa.
"Veden kanssa" tulemisen lisäksi se liukenee myös asetoniin, bentseeniin, etanoliin, eetteriin ja parafiiniin.
Höyryn tiheys
3.49 ilmassa.
Höyrynpaine
57,07 mmHg 25ºC: n lämpötilassa.
Henry Constant
66 μmol/pa · kg.
sytytyspiste
-15ºC.
Itsensuuntainen lämpötila
312ºC.
Lämpökapasiteetti
216,43 kJ/mol.
Palamislämpö
10.248 kalkki/g.
Höyrystyslämpö
34,84 kJ/mol.
Pintajännitys
20,22 N/m 25ºC.
Taitekerroin
1 400 - 20ºC.
Goo
0,347 MPa · S 25ºC: ssa.
Perusteettivakio
Trietilamiinilla on PKB, joka on yhtä suuri kuin 3,25.
Perusteetti
Tämän amiinin emäksisyys voidaan ilmaista seuraavalla kemiallisella yhtälöllä:
Voi palvella sinua: synteettiset polymeeritNetto3 + Hauton3+ + -Lla-
Missä se on heikko happolaji. NHET -pari3+-Lla- Se muodostaa siitä, että siitä tulee tertiäärinen ammoniumsuola.
NHET -konjugaattihappo3+ Se on vakaampi kuin ammonium, NH4+, Koska kolme etyyliryhmää luovuttavat osan elektronisesta tiheydestään typpiatomin positiivisen kuormituksen vähentämiseksi; Siksi trietyyliamiini on emäksisempi kuin ammoniakki (mutta vähemmän emäksinen kuin OH--A.
Sovellukset
 Reaktiot katalysoivat trietyyliamiini. Lähde: Tachymètre [julkinen alue].
Reaktiot katalysoivat trietyyliamiini. Lähde: Tachymètre [julkinen alue]. Perusteetti, tässä tapauksessa trietyyliamiinin nukleofiilisyyttä, katalysoimaan esterin ja amidien synteesiä tavallisesta substraatista: asyylikloridi, RCOCL (ylivoimainen kuva).
Täällä typpielektronit vapaa pari hyökkää karbonyyliryhmään muodostaen välittäjän; jota alkoholi tai amiinia hyökkää peräkkäin, vastaavasti esterin tai amidan muodostamiseksi.
Kuvan ensimmäisessä rivissä mekanismi, joka seuraa reaktiota esterin tuottamiseksi, visualisoidaan, kun taas toinen rivi vastaa AMIDA: ta. Huomaa, että molemmissa reaktioissa trietyyliamiinihydrokloridi tapahtuu, verkko3· HCl, josta katalyytti otetaan talteen uuden syklin aloittamiseksi.
Polymeerit
Trietyyliamiinin nukleofiilisyyttä käytetään myös tiettyjen polymeerien lisäämiseen, niiden parantamiseen ja niille suurempien massojen antamiseen. Esimerkiksi se on osa polykarbonoitujen hartsien, polyuretaanivaahtojen ja epoksihartsien synteesiä.
Kromatografia
Sen kauko -amfilisisuus ja haihtuvuus mahdollistaa sen johdettujen suolojen käytön reagenssina ioninvaihtokromatografiassa. Toinen implisiittinen trietyylemiinin käyttö on, että siitä voidaan hankkia useita tertiääristen amiinien suoloja, kuten trietyyliamiinikarbonaatti, NHET3HCO3 (tai Teab).
Voi palvella sinua: Kalorimetria: Mitä tutkimuksia ja sovelluksiaKaupalliset tuotteet
Sitä on käytetty lisäaineena savukkeiden ja tupakan, elintarvikkeiden säilöntäaineiden, lattian, aromien, torjunta -aineiden, väriaineiden jne. Formuloinnissa.
Riskejä
Trietyyliamiinin höyryt eivät ole vain epämiellyttäviä, vaan vaarallisia, koska ne voivat ärsyttää nenää, kurkkua ja keuhkoja aiheuttamaan keuhkojen turvotusta tai keuhkoputkentulehdusta. Samoin, että ne ovat tiheämpiä ja raskaita kuin ilma, ne pysyvät maanpinnan tasolla, siirtymällä mahdollisiin lämmönlähteisiin myöhemmin räjähtääkseen.
Tämän nesteen astioiden on oltava niin kaukana tulipalosta, koska ne edustavat välitöntä räjähdyksen vaaraa.
Lisäksi kosketus lajien tai reagenssien kanssa, kuten: alkalimetallit, triklooriietikkahappo, nitraatit, typpihappo (koska se muodostuisi nitrosoamiineja, syöpää aiheuttavia yhdisteitä), vahvoja happoja, peroksideja ja pervanganaatteja.
Sinun ei pitäisi koskettaa alumiinia, kuparia, sinkkiä tai sen seoksia, koska sillä on kyky syöpistää ne.
Fyysisen kontaktin suhteen se voi aiheuttaa allergia- ja ihottumia, jos valotus on akuutti. Keuhkojen lisäksi se voi vaikuttaa maksaan ja munuaisiin. Ja silmän kosketuksessa se aiheuttaa ärsytystä, mikä voi jopa vahingoittaa silmiä, jos niitä ei käsitellä tai puhdisteta ajoissa.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10. painos.-A. Wiley Plus.
- Wikipedia. (2019). Trietyyliamiini. Haettu: vuonna.Wikipedia.org
- Merkki. (2019). Trietyyliamiini. Toipunut: Sigmaaldrich.com
- Kansallinen bioteknologiatietojen keskus. (2019). Trietyyliamiini. Pubchem -tietokanta. CID = 8471. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Toksikologian tietoverkko. (S.F.-A. Trietyyliamiini. Palautettu: toxnet.Nlm.NIH.Hallitus
- New Jerseyn terveysministeriö. (2010). Trietyyliamiini. Palautettu: NJ.Hallitus
- « 10 uteliaisuutta keskiajalla, jotka yllättävät sinut
- Isoamilico -alkoholirakenne, ominaisuudet, käytöt ja riskit »

