Atomitilavuus
- 1957
- 191
- Louis Moen
Mikä on atomitilavuus?
Hän Atomitilavuus Se on suhteellinen arvo, joka osoittaa elementin molaarin ja sen tiheyden välisen suhteen. Sitten tämä tilavuus riippuu elementin tiheydestä, ja tiheys riippuu vaiheesta ja siitä.
Niin, että Z -elementin atomitilavuus ei ole sama toisessa eri vaiheessa kuin se, että se esiintyy huoneenlämpötilassa (neste, kiinteä tai kaasu) tai kun se on osa tiettyjä yhdisteitä. Siten z: n atomitilavuus ZB -yhdisteessä on erilainen kuin Z ZB -yhdisteessä.
Koska? Sen ymmärtämiseksi on tarpeen verrata atomeja esimerkiksi joidenkin marmorien kanssa. Marblesilla on materiaaliraja erittäin hyvin määritelty, mikä havaitaan heidän loistavan pinnan ansiosta. Toisaalta atomien reuna on diffuusi, vaikka niitä voidaan pitää etäpallomaisina.

Siten se, mikä määrittää atomisrajan ulkopuolella olevan pisteen, on tyhjyys todennäköisyys löytää elektronia, ja tämä kohta voi olla edelleen tai lähempänä ydintä riippuen siitä, kuinka monta naapuriatomia on vuorovaikutuksessa atomin ympärillä.
Atomitilavuus ja radio
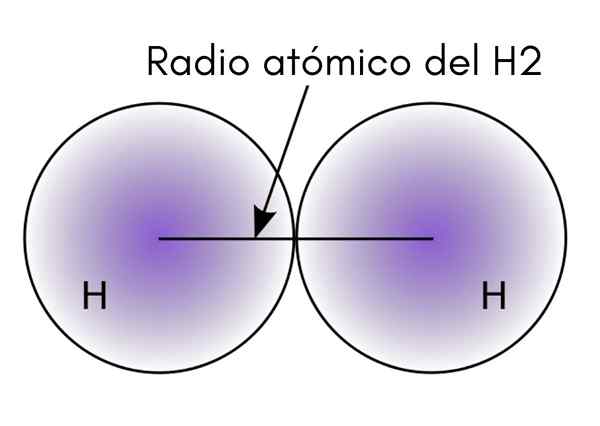
Kun olet vuorovaikutuksessa kaksi H -atomia H -molekyylissä2, Niiden ytimien sijainnit on määritelty samoin kuin niiden välillä (sisäiset etäisyydet). Jos molemmat atomit ovat pallomaisia, säde on ytimen ja diffuusion reunan välinen etäisyys:

Ylemmässä kuvassa voidaan nähdä, kuinka elektronin löytämisen todennäköisyys vähenee, kun se siirtyy pois ytimestä. Jakautuen kahdella sisäisen etäisyydellä, atomisäde saadaan. Sitten olettaen, että pallomainen geometria atomeille, kaavaa käytetään laskemaan pallon tilavuus:
V = (4/3) (pi) r3
Voi palvella sinua: PalavuusTässä ekspressiossa R on H -molekyylille määritetty atomisäde2. Tällä pienellä tarkalla menetelmällä laskettu V -arvo voi muuttua, jos esimerkiksi h harkitaan2 nestemäisessä tai metallisessa tilassa. Tämä menetelmä on kuitenkin erittäin epätarkka, koska atomien muodot ovat hyvin kaukana niiden vuorovaikutuksen ihanteellisesta palloista.
Kiinteän aineessa atomien määrien määrittämiseksi otetaan huomioon monet järjestelyä koskevat muuttujat, jotka saadaan x -rayn diffraktiotutkimuksilla.
Ylimääräinen kaava
Molaarimassa ilmaisee aineen määrän, jolla on kemiallisen elementin atomien mooli.
Sen yksiköt ovat g/mol. Toisaalta tiheys on tilavuus, joka vie elementin gramman: g/ml. Koska atomitilavuusyksiköt ovat ml/mol, sinun on leikkiä muuttujien kanssa haluttujen yksiköiden saavuttamiseksi:
- (g/mol) (ml/g) = ml/mol
Tai mikä on sama:
- (Molaarimassa) (1/d) = V
- (Molaarimassa/d) = v
Siten elementin atomien moolin tilavuus voi helposti laskea; Vaikka pallomaisen tilavuuden kaavan kanssa yksittäisen atomin tilavuus lasketaan.
Tämän arvon saavuttamiseksi ensimmäisestä, muuntaminen on välttämätön Avogadro -numeron kautta (6.02,10-23-A.
Kuinka vaihtelee atomitilavuuden jaksollisessa taulukossa?
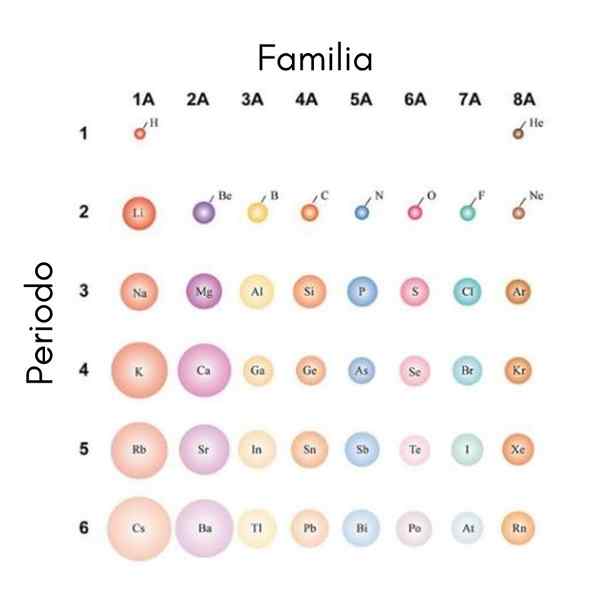
Jos atomeja pidetään pallomaisina, niiden variaatio on sama, jota havaitaan atomiradioissa. Ylemmässä kuvassa, joka näyttää edustavat elementit, havainnollistetaan, että atomit vasemmalle vasemmalle; Toisaalta ylhäältä alaspäin niistä tulee tilaa vieviä.
Tämä johtuu siitä, että samana ajanjaksona ydin sisältää protoneja, kun se liikkuu oikealle. Nämä protonit ovat vetovoiman ulkoisiin elektroneihin, jotka tuntevat tehokkaan ydinkuorman ZEF, vähäinen kuin todellinen ydinkuorma z.
Se voi palvella sinua: Disposio: rakenne, ominaisuudet, hankkiminen, käyttöSisäisten kerrosten elektronit torjuvat ulkokerroksen elektronit vähentäen ytimen vaikutusta niihin; Tätä kutsutaan näyttövaikutukseksi. Samana ajanjaksona näyttövaikutus ei torjuta protonien lukumäärän kasvua siten, että sisäkerroksen elektronit eivät estä atomien supistumista.
Ryhmässä laskeutuessa uusia energiatasoja on kuitenkin mahdollista, jotka antavat elektronien kiertää ytimen. Samoin sisäkerroksen elektronien lukumäärä kasvaa, joiden suojausvaikutukset alkavat vähentyä, jos ydin lisää protoneja uudelleen.
Näistä syistä on arvostettu, että ryhmässä 1A on kaikkein tilaa vieviä atomeja, toisin kuin ryhmän 8a (tai 18) pienet atomit, jalokaasujen atomit.
Siirtymämetallien atomialumit
Siirtymämetallien atomit sisältävät elektroneja sisäisiin kiertorauhaan d. Tämä lisäys näyttövaikutuksessa ja, samoin kuin todellinen ydinkuorma Z, on melkein tasa -arvoinen, joten niiden atomit säilyttävät samanlaisen koon samalla ajanjaksolla.
Toisin sanoen: Ajanjaksolla siirtymämetallit osoittavat samanlaisia atomimääriä. Nämä pienet erot ovat kuitenkin erittäin merkittäviä määritettäessä metallikiteitä (ikään kuin ne olisivat metallisia marmoreja).
Atomitilavuusesimerkit
Yhden elementin atomitilavuuden laskemiseksi on saatavana kaksi matemaattista kaavaa, jokaisella on vastaavat esimerkit.
Esimerkki 1
Kun otetaan huomioon atomi -radiogrogen -37 pm (1 pikometri = 10-12m)-ja cesium -265 pm-, laske atomitilavuutesi.
Voi palvella sinua: bentsaldehydiPallomaisen äänenvoimakkuuden kaavan avulla sinulla on sitten:
VH= (4/3) (3.14) (37 PM)3= 212,07 pm3
VCS= (4/3) (3.14) (265 PM)3= 77912297,67 pm3
Nämä pikometreissä ilmaistut volyymit ovat kuitenkin kohtuuttomia, joten ne muuttuvat angstroms -yksiköiksi kertomalla ne muuntokertoimella (1å/100 pm)3-
(212,07 pm3) (1å/100 pm)3= 21207 × 10-4 -Lla3
(77912297,67 pm3) (1å/100 pm)3= 77 912 Å3
Siten pienen H -atomin ja CS: n tilavan atomin välillä on numeerisesti todistettu. On tarpeen ottaa huomioon.
Esimerkki 2

Puhtaan kullan tiheys on 19,32 g/ml ja sen molaarimassa on 196,97 g/mol. M/d
VAu= (196,97 g/mol)/(19,32 g/ml) = 10,19 ml/mol
Eli se, että 1 mol kultaatomia on 10,19 ml, mutta mikä tilavuus on erityisesti kultatomi? Ja kuinka ilmaista se PM -yksiköissä3? Tätä varten käytä vain seuraavia muuntotekijöitä:
(10,19 ml/mol) · (mol/6,02 · 10-23 atomit) · (1 m/100 cm)3· (13 pm/10-12m)3= 16,92 · 106 p3
Toisaalta kullan atomisäde on 166 pm. Jos molempia volyymeja verrataan - aikaisemmalla menetelmällä saatu ja joka on laskettu pallomaisen tilavuuden kaavalla - havaitaan, että niillä ei ole samaa arvoa:
VAu= (4/3) (3.14) (166 PM)3= 19,15 · 106 p3
Mikä kahdesta on lähempänä hyväksyttyä arvoa? Se, joka on lähinnä kokeellisia tuloksia, jotka on saatu kullan kiteisen rakenteen x -diffraktiolla.

