Kalsiumoksidi (CAO)
- 796
- 11
- Eddie Hackett
Mikä on kalsiumoksidi?
Hän kalsiumoksidi (CAO) on epäorgaaninen yhdiste, joka sisältää kalsiumia ja happea ionisissa muodoissa (ei sekoittaa kalsiumperoksidin kanssa, CaO2-A. Maallinen tunnetaan nimellä kalkki, sana, joka osoittaa jokaisen epäorgaanisen yhdisteen, joka sisältää karbonaatteja, oksideja ja kalsiumhydroksideja, muiden metallien, kuten piin, alumiinin ja raudan, lisäksi.
Tähän oksidiin (tai kalkkiin) viittaa myös puhekielisesti eläväksi tai kalkiksi, riippuen siitä, onko se hydratoitunut vai ei. Elävä kalkki on kalsiumoksidia, kun taas kalkki on sen hydroksidi. Kalkkikivi puolestaan (kalkki tai karkaistu kalkki) on oikeastaan sedimenttikivi, joka koostuu pääasiassa kalsiumkarbonaatista (Caco3-A.
Se on yksi suurimmista luonnollisista kalsiumlähteistä ja muodostaa raaka -aineen kalsiumoksidin tuotantoon. Kuinka tämä oksidi tuotetaan? Karbonaatit ovat alttiita lämpöhajoamiselle; Kalsiumkarbonaattien lämmitys yli 825 ºC: n lämpötiloissa johtavat kalkin muodostumiseen ja hiilidioksidiin.
Edellinen lausunto voidaan kuvata seuraavasti: Caco3(S) → CAO (S) + Co2(g). Koska maankuoressa on runsaasti kalkkikiveä ja kalsiittia, ja valtamerellä ja rannalla merikuoret (raaka -aineet kalsiumoksidin tuottamiseksi) on runsaasti, kalsiumoksidi on suhteellisen halpa reagenssi.
Kaava
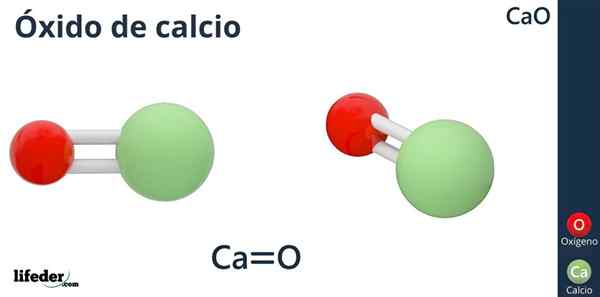
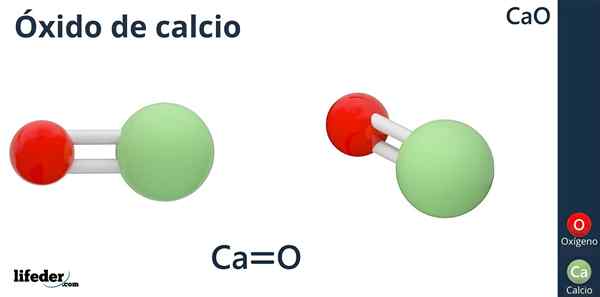
Kalsiumoksidin kemiallinen kaava on CaO, jossa kalsium on kuin happo -ioni (elektronia vastaan) CA2+, ja happi, kuten perusioni (elektronin luovuttaja) tai2--.
Miksi kalsiumilla on varaus +2? Koska kalsium kuuluu jaksollisen taulukon ryhmään 2 (SR. Scholambara), ja siinä on vain kaksi valenssielektronia, jotka ovat saatavana linkinmuodostukseen, mikä tuottaa happiatomiin.
Voi palvella sinua: kaliumoksidi (K2O)Kalsiumoksidirakenne
 Kalsiumoksidin kiteinen rakenne
Kalsiumoksidin kiteinen rakenne Kalsiumoksidin kiteinen rakenne (jalokivi -suolatyyppi) on esitetty ylemmässä kuvassa. Laajamuotoiset punaiset pallot vastaavat Ca -ioneja2+ ja valkoiset pallot ioneille tai2-.
Tässä kuutiossa kiteisessä järjestelyssä jokainen ioni CA2+ ympäröi kuusi ionia tai2-, Kulkeutuneet oktaedrisiin reikiin, joita suuret ionit ovat jättäneet.
Tämä rakenne ilmaisee tämän oksidin maksimiarvoksi, vaikka radioiden huomattava ero (punainen pallo on suurempi kuin valkoinen) antaa sille heikomman kiteisen retikulaarisen energian verrattuna MGO: hon verrattuna.
Kalsiumoksidin ominaisuudet
 Kalsiumoksidin ulkonäkö
Kalsiumoksidin ulkonäkö Fyysisesti se on kiteinen valkoinen kiinteä, wc ja vahvat sähköstaattiset vuorovaikutukset, jotka ovat vastuussa niiden korkeista sulautumispisteistä (2572 ºC) ja kiehumisesta (2850 ºC). Lisäksi sen molekyylipaino on 55 958 g/mol ja termoluminesenssin mielenkiintoinen ominaisuus.
Tämä tarkoittaa, että liekkille altistettu kalsiumoksidi voi loistaa voimakkaalla valkoisella valolla, joka tunnetaan englanniksi nimellä Parrasvalo, tai espanjaksi, kalsiumvalo. Ionit ca2+, Kosketuksessa tuleen, ne ovat punertavan liekin, kuten seuraavassa kuvassa voidaan nähdä.
 Kalsiumvalo tai parrasvalo
Kalsiumvalo tai parrasvalo Liukoisuus
CaO on emäksinen oksidi, jolla on voimakas affiniteetti veteen, siinä määrin, joka imee kosteutta (se on hygroskooppinen kiinteä), reagoi välittömästi kytketyn tai kalsiumhydroksidin tuottamiseksi:
Cao (t) + h2Tai (l) => ca (OH)2(S)
Tämä reaktio on eksoterminen (se luopuu lämmöstä) johtuen kiinteän kiinteän vuorovaikutuksen muodostumisesta ja stabiilimmasta kiteisestä verkosta. Reaktio on kuitenkin palautuvaa, jos CA (OH) lämmitetään2, kalkin kuivuminen ja valaistus; Sitten kalkki "uudestisyntynyt".
Voi palvella sinua: Safraniini: Ominaisuudet, käyttö, tekniikat, toksisuusTuloksena oleva liuos on hyvin emäksinen, ja jos se on kyllästetty kalsiumoksidilla, se saavuttaa pH: n 12,8.
Samoin se liukenee glyseroliin sekä happo- ja sokeriliuoksiin. Kuten emäksinen oksidi, sillä on luonnollisesti tehokkaita vuorovaikutuksia happosoksidien kanssa (SIO2, Siihen2JOMPIKUMPI3 ja usko2JOMPIKUMPI3, esimerkiksi) liukoinen niiden nestefaasiin. Toisaalta se on liukenematon orgaanisiin alkoholiin ja liuottimiin.
Käyttää/sovelluksia
CAO: lla on valtava lukemattomat teollisuuskäytöt, samoin kuin asetyleenisynteesissä (CHPOCH), jätevesifosfaattien uuttamisessa ja reaktiossa virvoitusjuomien rikkidioksidin kanssa.
Kalsiumoksidin muut käyttötarkoitukset on kuvattu alla:
Kuin laasti
Jos kalsiumoksidia sekoitetaan hiekan kanssa (SiO2) ja vesi, kakut hiekalla ja reagoi hitaasti veden kanssa tylsän kalkin muodostamiseksi. Vuorostaan CO2 Ilma liukenee veteen ja reagoi suolan kanssa pois päältä kalsiumkarbonaatin muodostamiseksi:
CA (OH)2(s) + Co2(g) => caco3(s) + h2Tai (l)
Caco3 Se on kestävämpi ja kovempi yhdiste kuin CAO, aiheuttaen laastin (edellinen seos) kovettua ja kiinnittämään tiilet, lohkot tai keramiikka.
Lasintuotannossa
Lasituotannon olennainen raaka -aine on piisoksidit, jotka sekoitetaan kalkin, natriumkarbonaatin kanssa (Na2Yhteistyö3) ja muut lisäaineet, ja sitten lämmitetään, mikä johtaa lasimaiseen kiinteään kiinteään. Tämä kiinteä kiinteä aine kuumennetaan myöhemmin ja puhalletaan mihin tahansa lukuun.
Kaivostoiminnassa
Tylsä kalkki vie suuremman tilavuuden kuin elävä kalkki vety sitojen vuorovaikutusten vuoksi (O-H-O). Tätä ominaisuutta käytetään hyödyntämään kallioita sen deemsistä.
Voi palvella sinua: katalyyttinen hydrausTämä saavutetaan täyttämällä ne pienellä kalkin ja veden seoksella, joka on suljettu keskittymään sen lämmön ja laajaan voimaansa kallion sisällä.
Silikoivan poistoaineena
CaO sulautuu silikaatteihin muodostuneen nesteen muodostamiseksi, joka sitten uutetaan raaka -aineesta tietystä tuotteesta.
Esimerkiksi raudan mineraalit ovat raaka -aine metallisen raudan ja teräksen tuottamiseksi. Nämä mineraalit sisältävät silikaatteja, jotka ovat epätoivottuja epäpuhtauksia prosessia varten ja eliminoitu äskettäin kuvattulla menetelmällä.
Kalsiumoksidin nanohiukkaset
Kalsiumoksidi voidaan syntetisoida nanohiukkasina, vaihtelevat kalsiumnitraattipitoisuudet (CA (ei3-A2) ja natriumhydroksidi (NaOH) liuoksessa.
Nämä hiukkaset ovat pallomaisia, emäksisiä (samoin kuin kiinteä makroasteikko) ja niillä on paljon pinta -alaa. Näin ollen nämä ominaisuudet hyödyttävät katalyyttisiä prosesseja. Mikä? Tutkimukset vastaavat tällä hetkellä tähän kysymykseen.
Näitä nanohiukkasia on käytetty syntetisoimaan substituoituja orgaanisia yhdisteitä - jotka on johdettu pyridiinistä - uusien lääkkeiden formuloinnissa kemiallisten muutosten, kuten keinotekoisen fotosynteesin suorittamiseksi, veden puhdistamiseksi raskaista ja haitallisista metalleista ja fotokatalyyttisinä agentteina.
Nanohiukkaset voidaan syntetisoida biologisella tuella, kuten papaija- ja vihreän teen lehdet, jotta ne käyttävät antibakteerina aineena.
Viitteet
- Scifun.org. (2018). Kalsiumoksidi. Toipunut: scifun.org.
- Wikipedia. (2018). Kalsiumoksidi. Haettu: vuonna.Wikipedia.org
- Pubchem. (2018). Kalsiumoksidi. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Shiver & Atkins. (2008). Epäorgaaninen kemia. Sisään Ryhmän 2 elementit. (Neljäs painos., p. 280). MC Graw Hill.