Kromioksidi (III) rakenne, nimikkeistö, ominaisuudet, käyttää

- 4368
- 233
- Eddie Hackett
Hän Kromioksidi (III) U -kromioksidi on epäorgaaninen vihreä kiinteä aine, joka muodostuu polttamalla kromimetallia (CR) happea (tai2), Chromen poistuminen hapetustilasta 3+. Sen kemiallinen kaava on CR2JOMPIKUMPI3. Luonnossa sitä löytyy Eskolaíta -mineraalista. Kromioksidin (III) luonnollisia kerrostumia ei tunneta.
Se voidaan valmistaa muun muassa lämmittämällä Cr2JOMPIKUMPI3 hydratoitu (CR2JOMPIKUMPI3.Nh2O) veden poistamiseksi kokonaan. Se saadaan myös kromioksidin kalsinoinnin (VI) (CRO3-A.
 Kromioksidipigmentti (III). FK1954 [julkinen alue]. Lähde: Wikipedia Commons
Kromioksidipigmentti (III). FK1954 [julkinen alue]. Lähde: Wikipedia Commons Paras tapa saada se puhdasta on kuitenkin hajottamalla ammoniumdikromaatti (NH4-A2Cr2JOMPIKUMPI7 200 ºC. Teollisesti tuotetaan vähentämällä natriumdikromaattia (NA2Cr2JOMPIKUMPI7) kiinteä rikki.
Kun se on hienosti jaettu, se tarjoaa kirkkaan vihreän värin kellertävällä vivahteella. Mutta jos hiukkaset ovat suurempia, sillä on sinertävä väriaine. Kromioksidi on stabiilin vihreä pigmentti, joka tunnetaan. Sen lämpö- ja kemiallinen vastus tekee siitä arvokkaan keraamisen väriaineen.
Sitä käytetään teollisuuspinnoitteissa, lakkoissa, rakennusteollisuudessa, koruissa, kosmetiikan värityksenä tai lääketuotteissa, muun muassa.
[TOC]
Rakenne
Α-CR-oksidi2JOMPIKUMPI3 Sillä on Corindon -tyyppinen rakenne. Sen kiteinen järjestelmä on rhombooni -kuusikulmainen. On isomorfinen a-alumiinioksidilla ja a-fe: llä2JOMPIKUMPI3.
Eskolaíta, kromioksidin luonnollinen mineraali (III), esittelee alla esitettyä rakennetta:
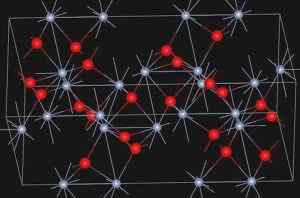 Eskolaíta -mineraalin kiderakenne. https: // Lataa.Wikimedia.org/wikipedia/commons/e/ee/eskolaite_structure.JPG. Lähde: Wikipedia Commons
Eskolaíta -mineraalin kiderakenne. https: // Lataa.Wikimedia.org/wikipedia/commons/e/ee/eskolaite_structure.JPG. Lähde: Wikipedia Commons Nimikkeistö
- Kromioksidi (III).
- Vihreä kromioksidi.
- Dikroma -trioksidi.
- Kromin merenkulku.
- Kromia.
- Eskolaíta: kromioksidimineraali (III).
- Hydraatti: CR2JOMPIKUMPI3.Nh2Tai (missä n ≅ 2) kutsutaan kromioksidihydraattiin (III) tai guignet vihreäksi.
 Kromioksidihydraatti (III). W -. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons
Kromioksidihydraatti (III). W -. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikipedia Commons Ominaisuudet
Fyysinen tila
Kiteinen kiinteä.
Mohsin kovuus
9 (niiden kiteet ovat erittäin kovia).
Molekyylipaino
151,99 g/mol.
Voi palvella sinua: kvaternääriset yhdisteet: ominaisuudet, koulutus, esimerkitSulamispiste
Sulaa 2435 ºC: n nopeudella, mutta se alkaa haihtua 2000 ºC: iin muodostaen vihreän savun pilviä.
Tiheys
5,22 g/cm3
Liukoisuus
Kun sitä on lämmitetty korkeissa lämpötiloissa, se on käytännössä liukenematon veteen (3 mikrogrammaa/L 20ºC: ssa); liukenematon alkoholiin ja asetoniin; liukenee hiukan hapoihin ja alkaliin; perkloorihappo SSoluple (HCLO4) 70%: iin, jossa se hajoaa.
PHE
6.
Taitekerroin
2 551.
Muut ominaisuudet
- Jos se on voimakkaasti kalsinoinut, siitä tulee inertti happoja ja emäksiä. Muuten cr2JOMPIKUMPI3 ja sen hydratoitu muoto cr2JOMPIKUMPI3.Nh2O Ne ovat amfoteerisiä, liukenevia helposti happea saamaan vesi -ioneja [CR (H2JOMPIKUMPI)6-3+, ja konsentroituneessa alkalissa "kromitos".
- Kun se on kalsinoinut, se on kemiallisesti kestävä hapolle, alkalille ja korkeille lämpötiloille. On erittäin vakaa niin2.
- Sillä on erinomainen valonkestävyys, koska sen kiteillä on opasiteetti, korkea UV -vaimennus ja läpinäkyvyys näkyvään valoon.
- Se on erittäin kova materiaali, voit raaputtaa kvartsia, Tapacioa ja Zirconioa.
- Sen hydraatti cr2JOMPIKUMPI3.Nh2Tai (missä n ≅ 2) ei ole lämpöstabiilisuutta, sen nesteysvesi rajoittaa sen sovellettavuuden alle 260 ºC. Siinä on alhainen värjäyskyky ja rajallinen vivahteiden vivahte.
- Mutta tällä hydraatilla on erittäin puhdas ja kirkkaan vihreä sininen sävy. Se on puoliksi läpinäkyvä, se on alhainen opasiteetti, erinomainen valonkestävyys ja vastus emäksille.
- Cr2JOMPIKUMPI3 Sitä ei luokitella vaaralliseksi materiaaliksi, ja sitä pidetään inerttinä hienona jauheena. Sitä ei sovelleta kansainvälisiin kuljetusmääräyksiin.
- Ei ärsytä ihoa tai limakalvoja.
Sovellukset
Keraamisessa ja lasiteollisuudessa
CR: n korkean lämmön ja kemiallisen kestävyyden kestävyyden vuoksi CR2JOMPIKUMPI3 Kalsinoituaan käytetään väritysväritys- tai lasitettavissa olevana pigmentinä keraamisessa valmistuksessa, posliinikemelissä ja lasin seoksissa.
Teollisuuspinnoitteina
Keramiikka kromioksidilla (III) tarjoaa erinomaisen vastustuskyvyn syövyttävistä ympäristöistä. Kaikki tämä ympäröivän substraatin sulkemisen mekanismin kautta.
Tästä syystä sitä käytetään pinnoitteissa monien materiaalien korroosion estämiseksi, ja sitä levitetään lämpösuihkeella (atomisointi tai kuuma kaste).
Voi palvella sinua: kemiallinen prosessi: periaatteet, tyypit, esimerkitSitä käytetään myös suojauksena hankaavaa kulumista (kun materiaalin poistaminen johtuu hiukkasista, jotka liikkuvat pinnan läpi).
Näissä tapauksissa CR -pinnoitteen soveltaminen2JOMPIKUMPI3 Selvityksellä plasmalla, se tuottaa suurta hankauskestävyyttä.
Kahdessa edellisessä tapauksessa on hyötyä, esimerkiksi kaasuturka -turbiinimoottorit.
Tulenkestävässä teollisuudessa
Sitä käytetään lämpö- ja kemiallisesti kestävissä tiileissä, pinnoittimateriaaleissa ja alumiinioksidipohjaisessa tulenkestävässä betonissa.
Rakenteilla
Koska se on erittäin kestävä ilmakehän olosuhteille, valolle ja lämmölle, sitä levitetään rakeistettuna kiviväriaineena asfalttikattoille, betonisementille, korkealaatuisille teollisuuspinnoitteille ulkopuolelle, teräsrakenteille ja julkisivuille (emulsioitavat maalit).
Pigmenttinä monimuotoisissa sovelluksissa
Se voi tukea vulkanointiolosuhteita eikä hajoa, joten sitä käytetään kumipigmentoinnissa.
Koska ne ovat ei-teknisiä, sitä käytetään lelujen, kosmetiikan (erityisesti sen hydraatti), muovien, tulostusmusteiden, maalausten kanssa, jotka ovat kosketuksissa ruoan ja lääketuotteiden kanssa.
Pigmenttiteollisuudessa sitä käytetään raaka -aineena tunkeutuvien väriaineiden tuottamiseksi, jotka sisältävät kromia ja pigmenttejä sekoitettujen metallioksidien vaiheisiin. Sitä käytetään myös maalauksien väriä kelapäällysteelle.
Sen hydraatilla on läpinäkyvyys, joka mahdollistaa polykromaattisten viimeistelyjen muotoilun autoteollisuudessa (metalliset autojen viimeistelyt).
Koska infrapuna säteily (IR) heijastavat ainutlaatuista ominaisuutta kuin kasvit klorofylli, infrapunavalossa se näyttää lehtineen. Tästä syystä sen käyttö naamiointimaalauksissa tai pinnoitteissa sotilaallisiin sovelluksiin on erittäin laajalle levinnyt.
Koruissa
Sitä käytetään synteettisten jalokivien väriaineena. Kun CR otetaan käyttöön2JOMPIKUMPI3 epäpuhtauksina α-al: n kiteisessä verkossa2JOMPIKUMPI3, Kuten puolijalo-Ruby-mineraalissa, väri on punainen vihreän sijasta.
Sitä käytetään myös hioma -aineena ja kiillotetaan korkean kovuuden ja hioma -ominaisuuksien suhteen.
Kemiallisissa reaktioissa
Tuetaan alumiinioksidissa (2JOMPIKUMPI3) tai muita oksideja, käytetään orgaanisessa kemiassa katalyyttinä, esimerkiksi estereiden tai aldehydien hydraamisessa alkoholien muodostamiseksi ja hiilivetyjen syklisoinnissa. Katalysoi typen reaktiota (n2) vedolla (H2) Muodostaa ammoniakki (NH3-A.
Se voi palvella sinua: litium: historia, rakenne, ominaisuudet, riskit ja käytötSen oksidin vähentämiskyky, joka toimii yhdessä kromioksidin (VI) kanssa2 Propenon ja isobuteenin tuottaminen, koska katalyytin deaktivointi-reaktiosykli on helposti suoritettava. Sitä käytetään myös epäorgaanisen kemian katalysaattorina.
Kromin valmistuksessa
Sitä käytetään puhtaan kromimetallin alumiinitermisessä tuotannossa. Tätä varten se on lämmitettävä 1000 ºC: seen sen raekokojen lisäämiseksi.
 Kromimetallivalmistus kromioksidin (III) alumiinitermisellä pelkistyksellä (III). Rando Tuikene [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons
Kromimetallivalmistus kromioksidin (III) alumiinitermisellä pelkistyksellä (III). Rando Tuikene [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikipedia Commons Magneettisissa materiaaleissa
Sitä on lisätty pieninä määrinä ääni- ja videonauhojen magneettisiin materiaaleihin opettamalla itsensä imevä efekti äänille.
Viimeaikaiset innovaatiot
On saatu pigmenttejä, jotka ovat parantuneet lähelle menemistä Dopar CR -anohiukkasiin2JOMPIKUMPI3 Harvinaiseen maametalliryhmään kuuluvien elementtien suoloilla, kuten Lantano ja Praseodimio.
Lisäämällä näiden elementtien pitoisuutta, lähellä olevien infrapuna -infrapuna -aurinkoenergian heijastuskyky on vaikuttamatta Cr Pian vihreään väriin2JOMPIKUMPI3.
Tämä mahdollistaa CR: n luokittelun2JOMPIKUMPI3 Doping "kylmänä" pigmentinä, koska se sopii lämmön kertymisen hallintaan.
Kattoihin, autoihin ja verhoiluun sovelletaan muun muassa IR -auringonvalon suurta heijastuskykyä, mikä antaa meille mahdollisuuden vähentää merkittävästi lämmön nousua ympäristöissä.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Osa 19. Neljäs painos. John Wiley & Sons.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Volume A7 ja A20. Vch verlagsgellschaft mbh.
- Amerikkalaiset elementit. (2019). Kromioksidi (III). Toipunut amerikkalaisista.com.
- Lääketieteen kansalliskirjasto. (2019). Kromioksidi (III). Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus.
- Dorfman, Mitchell R. (2012). Lämpömyrskypinnoitteet. Materiaalien ympäristön heikkenemisen käsikirjassa. Luku 19. ScienEdirect.com.
- Takehira, k. et al. (2004). Yhteistyö2 Propaanin dehydra Cr-MCM-41-katalyyttillä. Pintatieteen ja katalyysin tutkimuksissa 153. ScienEdirect.com.
- Selvam Sangetha et ai. (2012). Kromi (III) -nanohiukkasoksidin funktionaaliset pigmentit. Dyes and Pigments 94 (2012) 548-552. ScienEdirect.com.

