Rautaoksidi

- 3333
- 72
- Joshua Emmerich
 Rautaoksidi on kemiallinen yhdiste raudan ja hapen välillä
Rautaoksidi on kemiallinen yhdiste raudan ja hapen välillä Mikä on rautaoksidi?
Hän rautaoksidi Se on mikä tahansa yhdisteet, jotka on muodostettu raudan ja hapen väliin. Niille on ominaista ioninen ja kiteinen, ja ne ovat hajallaan mineraaliensa eroosion seurauksena.
Se on yksi maankuoressa vallitsevien yhdisteiden perheistä. Rautaoksidit tunnetaan tähän mennessä, suurin osa niistä on luonnollista alkuperää ja muita syntetisoituja äärimmäisissä paine- tai lämpötila -olosuhteissa.
Yläkuvassa esitetään osa rautaoksidijauhetta. Sen ominainen punainen väri kattaa useiden arkkitehtonisten elementtien rautaa ns. Samoin sitä havaitaan rinteillä, vuorilla tai maaperällä, sekoitettuna monien muiden mineraalien kanssa, kuten goethitan keltainen pöly (α-feOOH).
Tunnetuimmat rautaoksidit ovat hematiitti (a-fe2JOMPIKUMPI3) and Maghemita (ϒ-faith2JOMPIKUMPI3), molemmat rautaoksidin polymorfit; Ja vähiten, magnetiitti (usko3JOMPIKUMPI4-A.
Niiden polymorfiset rakenteet ja sen suuri pinta -ala on valmistettu mielenkiintoisilla materiaaleilla, kuten Sorbentes, tai nanohiukkasten synteesiä laajoilla sovelluksilla.
Rautaoksidirakenne
Yläkuva on esitys ruman kiteisestä rakenteesta, joka on yksi rautaoksideista, joissa rauta on valenssi +2. Punaiset pallot vastaavat anioneja tai2-, Kun taas keltaiset uskon kationit2+.
Huomaa, että jokainen usko2+ ympäröi kuusi tai2-, Oktaedrisen koordinointiyksikön muodostaminen.
Siksi ruma rakenne voi "murentua" rumaissa yksiköissä6, Missä keskeinen atomi on usko2+. Oksihydroksidien tai hydroksidien tapauksessa oktaedrinen yksikkö on ruma3(VAI NIIN)3.
Voi palvella sinua: Kalsiumperoksidi (CAO2): Ominaisuudet, riskit ja käytötJoissakin rakenteissa Oktaedronin sijasta on tetraedrisia yksiköitä, ruma4. Tästä syystä rautaoksidit ovat yleensä edustettuna okratiivilla tai tetraedulla rautakeskuksilla.
Rautaoksidirakenteet riippuvat paine- tai lämpötila -olosuhteista uskosta/tai suhteesta (ts. Kuinka monta happea on rautaa ja päinvastoin) ja Valencia del Hierro (+2, +3 ja, hyvin harvoin synteettisissä oksideissa , +4).
Yleensä tilaa vievät anionit tai2- Ne kohdistavat muotoilun arkki2+ tai usko3+. Siten on oksideja (kuten magnetiitti), joissa on rautaa, joilla on molemmat valenssit.
Polymorfismi
Rautaoksidilla on polymorfismi, toisin sanoen erilaiset rakenteet tai kiteiset järjestelyt samoille yhdisteille. Rautaoksidi, usko2JOMPIKUMPI3, on jopa neljä mahdollista polymorfia. Hematiitti, α-FE2JOMPIKUMPI3, Se on kaikkein vakain; seurasi Maghemita, ϒ-uskonto2JOMPIKUMPI3, ja synteettiseen β- uskoon2JOMPIKUMPI3 ja ε- usko2JOMPIKUMPI3.
Kaikilla heillä on omat kiteiset rakenteet ja järjestelmät. Osuus 2: 3 pysyy kuitenkin vakiona, joten on kolme anionia tai2- Jokaisesta kahdesta katiosta3+.
Ero on siinä, kuinka ruma oktaedriset yksiköt sijaitsevat6 avaruudessa ja miten he tulevat yhteen.
Rakenteelliset linkit
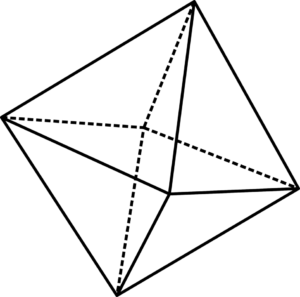 Ruma oktaedrinen yksikkö6
Ruma oktaedrinen yksikkö6 Ruma oktaedriset yksiköt6 voidaan visualisoida ylemmän kuvan avulla. Octaedron nurkissa ovat tai2-, kun sen keskellä on usko2+ tai usko3+(Uskon tapauksessa2JOMPIKUMPI3-A. Tapa, jolla nämä oktaedrat on järjestetty avaruuteen, paljastaa ruosterakenteen.
Ne vaikuttavat kuitenkin myös siihen, miten he linkittävät. Esimerkiksi kaksi oktaedraa voi liittyä kahteen heidän kärkiään, joita edustaa happisilta: fe-o-fe. Samoin oktaedra voi liittyä reunojensa kautta (vieressä toistensa kanssa). Sitten se esitetään kahdella happisiltolla: fe- (o)2-Usko.
Voi palvella sinua: kloorioksidi (V): Ominaisuudet, rakenne, käyttöJa lopuksi oktaedra voi olla vuorovaikutuksessa heidän kasvonsa kautta. Siten esitys olisi nyt kolmella happisiltaa: fe- (o)3-Usko. Tapa, jolla oktaedra on yhteydessä toisiinsa, sisäiset etäisyydet Fe -Fe vaihtelee ja siksi oksidin fysikaaliset ominaisuudet.
Rautaoksidi -ominaisuudet
Rautaoksidi on yhdiste, jolla on magneettiset ominaisuudet. Nämä voivat olla anti-, ferro- tai ferrimagneettisiä ja riippuvat uskon valensseista ja siitä, kuinka kationit ovat vuorovaikutuksessa kiinteissä.
Koska kiinteät rakenteet ovat hyvin monipuolisia, samalla tavalla niiden fysikaaliset ja kemialliset ominaisuudet ovat.
Esimerkiksi uskon polymorfit ja hydraatit2JOMPIKUMPI3 Niillä on erilaiset sulatuspisteiden arvot (jotka vaihtelevat välillä 1.200 ja 1.600 ° C) ja tiheydet. Heillä on kuitenkin vähän liukoisuutta uskon jälkeen3+, Sama molekyylimassa on ruskeita värejä ja ne ovat tuskin liuenneet happoliuoksiin.
Rautaoksidien nimikkeistö
IUPAC asettaa kolme tapaa nimetä rautaoksidi. Kolme ovat erittäin hyödyllisiä, vaikka monimutkaisille oksideille (kuten usko7JOMPIKUMPI9) Systemaattinen hallitsee muita sen yksinkertaisuuden vuoksi.
Järjestelmällinen nimikkeistö
Happi- ja raudan lukumäärät otetaan huomioon, nimeämällä ne mono-mono-, di-, tri-, jne. Etuliitteillä. Tämän nimikkeistön mukaan usko2JOMPIKUMPI3 kutsutaan: Trioksidi antaarauta. Ja uskon vuoksi7JOMPIKUMPI9 Hänen nimensä olisi: heptahierro ei -aksidi.
Nimikkeistö
Tämä harkitsee Valencia del Hierroa. Jos se on usko2+, Rautaoksidi on kirjoitettu ... ja sen valenssi roomalaisilla numeroilla lukittuna suluihin. Uskon2JOMPIKUMPI3 Hänen nimensä on: rautaoksidi (III).
Voi palvella sinua: höyrynpaine: käsite, esimerkit ja harjoitukset ratkaistuHuomaa, että usko3+ Se voidaan määrittää algebrallisilla summilla. Joo2- Sillä on kaksi negatiivista maksua, ja niitä on kolme, lisää -6. Tämän -6 neutraloimiseksi ne vaativat +6, mutta uskoa on kaksi, niin että ne on jaettava kahdella, +6/2 = +3:
2x (metalli Valencia) + 3 (-2) = 0
Yksinkertaisesti puhdistamalla uskon valenssi oksidissa. Mutta jos X ei ole kokonaisluku (kuten melkein kaikkien jäljellä olevien oksidien kanssa), niin on sekoitus uskoa2+ ja usko3+.
Perinteinen nimikkeistö
Jälkiliite -CO myönnetään etuliitteelle Ferr- kun uskolla on Valencia +3 ja -niin, kun sen Valencia on 2+. Siten usko2JOMPIKUMPI3 kutsutaan: rautaoksidi.
Rautaoksidit käyttävät
Nanohiukkaset
Rautaoksideilla on korkea kiteytysenergia, joka mahdollistaa hyvin pienten kiteiden luomisen, mutta suurella pinta -alalla.
Tästä syystä he ovat kiinnostavia nanoteknologian aloilla, joissa he suunnittelevat ja syntetisoivat oksidinanohiukkasia (NP) tiettyihin tarkoituksiin:
- Katalysaattoreina.
- Lääkkeen säiliönä tai kehon geeneinä.
- Aistipintojen suunnittelussa erityyppisille biomolekyyleille: proteiinit, sokerit, rasvat.
- Magneettisen tiedon tallentaminen.
Pigmentit
Koska jotkut oksidit ovat erittäin stabiileja, ne toimittavat tekstiilejä tai antavat kirkkaat värit minkä tahansa materiaalin pinnoille. Lattioiden mosaiikoista -punainen, keltainen ja oranssi (jopa vihreä) maalaukset -muovit, nahka arkkitehtuurit.
Viitteet
- Dartmouth -yliopiston edunvalvojat (18. maaliskuuta 2004). Rautaoksidien stökiometria. Otettu: Dartmouth.Edu
- Ryosuke Sinmyo et ai. (8. syyskuuta 2016). Fe: n löytäminen7JOMPIKUMPI9: Uusi rautaoksidi, jolla on kompleksi monokliininen rakenne. Toipunut: luonto.com
- M. Cornell, u. Schwertmann. Rautaoksidit: rakenne, ominaisuudet, reaktio, tapahtumat ja käytöt [PDF]. Wiley-VCH. Otettu: EPSC511.Viipale.Edu

