Elohopeaoksidi (HG2O)
- 2294
- 130
- Edgar VonRueden
Mikä on elohopeaoksidi?
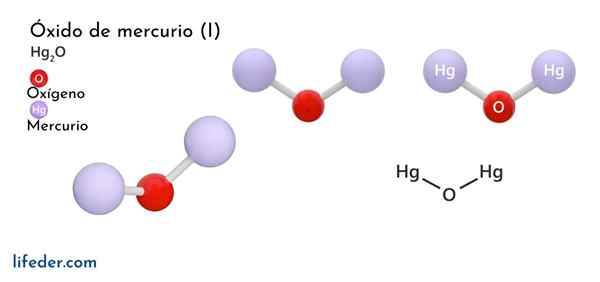
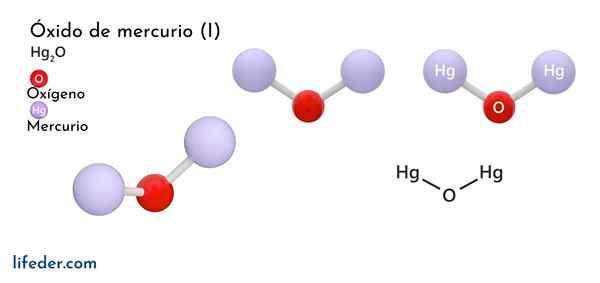
Hän Elohopeaoksidi (I) U -rautaoksidi, jonka kemiallinen kaava on esitetty Hg2Tai se on kiinteän faasikomeer, jota pidetään myrkyllisenä ja epävakaana kemiallisesta näkökulmasta, muuttuen elohopeaksi sen perusmuotona ja elohopeaoksidiksi (II).
On vain kaksi kemiallista lajia, jotka voivat muodostaa elohopean yhdistettynä happea, koska tällä metallilla on kaksi vain hapettumistilaa (HG+ ja hg2+): Elohopeaoksidi (i) ja elohopeaoksidi (ii). Elohopeaoksidi (II) on kiinteän aggregaation tilassa, saadaan kahdessa suhteellisen stabiilissa kiteisessä muodossa.
Tätä yhdistettä kutsutaan myös yksinkertaisesti elohopeaoksidiksi, joten vain tätä lajia käsitellään tässä. Hyvin yleinen reaktio, joka tapahtuu tällä aineella.
Kemiallinen rakenne
Ilmakehän paine -olosuhteissa tämä laji esitetään kahdessa kiteisessä muodossa: SO -niminen cinabrio ja toinen, joka tunnetaan nimellä Montrodite, joka on hyvin harvinaista. Molemmat muodot muunnetaan tetragonaaliksi yli 10 GPA paineen.
Cinnabrion rakenne perustuu primitiivisiin kuusikulmaisiin soluihin (HP6) trigonaalisella symmetrialla, jonka kierteinen akseli on suunnattu vasemmalle (P32kaksikymmentäyksi); Toisaalta montrodiitin rakenne on ortorrominen, joka perustuu primitiiviseen verkkoon, joka muodostaa liukutasoja kohtisuoraan kolmeen akseliin (PNMA).
Sitä vastoin kaksi elohopeaoksidin muotoa voidaan erottaa visuaalisesti, koska toinen on punainen ja toinen keltainen. Tämä värin ero tapahtuu hiukkasen mittojen ansiosta, koska kahdella muodolla on sama rakenne.
Se voi palvella sinua: Circononium: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetElohopea -oksidin punaisen muodon tuottamiseksi, happea metallisesta elohopealämmityksestä lämpötilassa noin 350 ° C tai elohopeanitraattipyrolyysiprosessissa (II) (Hg (ei3-A2-A.
Samoin tämän oksidin keltaisen muodon tuottamiseksi2+ Vesipitoisessa muodossa pohjalla.
Elohopeaoksidiominaisuudet
- Sen sulamispiste on noin 500 ° C (vastaa 773 K), jonka yläpuolella se kärsii hajoamisesta ja molaarimassa tai molekyylipaino 216,59 g/mol.
- Se on kiinteän aggregaation tilassa eri väreissä: oranssi, punainen tai keltainen, dispersion asteen mukaan.
- Se on epäorgaaninen oksidi, jonka osuus hapen kanssa on 1: 1, mikä tekee siitä binaarilajin.
- Sitä pidetään liukenemattomana ammoniakki-, asetonissa, eetterissä ja alkoholissa sekä muissa orgaanisissa luonteessa.
- Sen liukoisuus veteen on erittäin alhainen, ja se on noin 0,0053 g/100 ml tavanomaisessa lämpötilassa (25 ° C) ja kasvaa lämpötilan noustessa.
- Sitä pidetään liukoisena useimmissa hapoissa; Keltainen muoto osoittaa kuitenkin suuremman reaktiivisuuden ja suuremman liukenemiskapasiteetin.
- Kun elohopeaoksidi altistetaan hajoamiselle, kun sen punainen muoto tekee sen altistuessaan valonlähteille.
- Kuumenemisen lämpötilaan, jossa hän hajoaa.
- Vain kun sitä lämmitetään 300-350 ° C: n elohopeaan, voidaan yhdistää happea kannattavalla nopeudella.
Voi palvella sinua: kemialliset suspensiotKäyttää/sovelluksia
Sitä käytetään edeltäjänä peruselohopean saamisessa, koska se kärsii hajoamisprosesseista melko helpolla tavalla; Se puolestaan hajottaessa se tuottaa happea sooda -muodossaan.
Samoin tätä epäorgaanista luonteenoksidia käytetään anionisten lajien vakiotyypin arvonrahoittavana aineena, koska muodostuu yhdiste, jolla on suurempi stabiilisuus kuin sen alkuperäisessä muodossa.
Tässä mielessä elohopeaoksidikokemus liukeneminen, kun sitä löytyy emäksisten lajien tiivistetyistä liuoksista, tuottaen yhdisteitä, joita kutsutaan hydroksomplekseiksi.
Nämä yhdisteet ovat monimutkaisia M -rakenteen kanssax(VAI NIIN)ja, missä m edustaa metallista atomia ja alaindeksit x y y edustaa kuinka monta kertaa lajeja löytyy molekyylistä. Ne ovat valtavia hyödyllisiä kemiallisissa tutkimuksissa.
Lisäksi elohopeaoksidia (II) voidaan käyttää laboratorioissa erilaisten metallisuolojen tuotantoon; Esimerkiksi elohopeaasetaatti (II), jota käytetään orgaanisissa synteesiprosesseissa.
Tätä yhdistettä käytetään myös grafiitin kanssa sekoitettuna katodisen elektrodin materiaalina elohopeaparistojen ja sähkön ja sinkkioksidityyppisten solujen tuotannossa.
Riskejä
- Tämä aine, joka ilmenee perusominaisuuksia erittäin heikosti, on erittäin hyödyllinen reagenssi erilaisille sovelluksille, kuten edellä mainituille.
- Elohopeaoksidilla on korkea toksisuus, hengitysteiden kyvyttömyys absorboida, koska se antaa ärsyttäviä kaasuja, kun se on aerosolin muodossa, sen lisäksi, että se on erittäin myrkyllinen se on kosketuksessa suoraan tämän kanssa.
Voi palvella sinua: Kiraliteetti- Tämä yhdiste aiheuttaa silmien ärsytystä ja voi vahingoittaa munuaisia, jotka myöhemmin johdetaan munuaisten vajaatoiminnoista.
- Kun vesilajit kuluttavat tavalla tai toisella, tämä kemikaali on näissä bioacumula ja vaikuttaa ihmisen organismiin, jotka kuluttavat niitä säännöllisesti.
- Elohopeaoksidin lämmitys on peräisin elohopeahöyryistä, joilla on korkea toksisuus kaasun hapen lisäksi, mikä lisää syttymisriskiä; toisin sanoen tulipalojen tuottaminen ja palamisen parantaminen näissä.
- Tällä epäorgaanisella oksidilla on voimakas hapettumiskäyttäytyminen, joten se tuottaa väkivaltaisia reaktioita, kun se on kosketuksissa pelkistävien aineiden ja tiettyjen kemiallisten aineiden, kuten rikkikloridin, kanssa (Cl2S2), vetyperoksidi (H2JOMPIKUMPI2), kloori ja magnesium (vain kun hän lämmitetään).