Kultaoksidi (III) (AU2O3) Mikä on, rakenne, ominaisuudet, käyttää
- 3880
- 161
- Edgar VonRueden
Hän kultaoksidi (III) Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on AU2JOMPIKUMPI3. Teoreettisesti sen luonnetta voidaan odottaa kovalenttisen tyypin ulkopuolella. Tietyn ionisen luonteen läsnäoloa kiinteässään ei kuitenkaan voida täysin sulkea pois; tai mikä on sama, oletetaan3+ Anionin tai2-.
Voi vaikuttaa ristiriitaiselta, että kulta, joka on jalo metalli, voi hapettaa. Normaaliolosuhteissa kultapalat eivät voi hapettua kosketuksella ilmakehän hapen kanssa; Kuitenkin, kun ne säteilytetään ultraviolettisäteilyllä otsonin läsnä ollessa tai3, Panoraama on toinen.
Jos kultatähdet käyvät läpi nämä olosuhteet, niistä tulee punertavan ruskea väri, joka on ominainen AU: lle2JOMPIKUMPI3.
Muut menetelmät tämän oksidin saamiseksi tarkoittaisivat näiden tähtien kemiallista käsittelyä; Esimerkiksi kullan taikinan muuttaminen vastaavaksi kloridiksi, AUCL3.
Sitten AUCL: lle3, Ja loput mahdollisista muodostetuista kultasuoloista lisätään vahva perusväliaine; Ja tällä saadaan hydratoitu tai hydroksidioksidi, AU (OH)3. Lopuksi, jälkimmäinen yhdiste on kuivunut termisesti AU: n saamiseksi2JOMPIKUMPI3.
Kultaoksidirakenne (III)
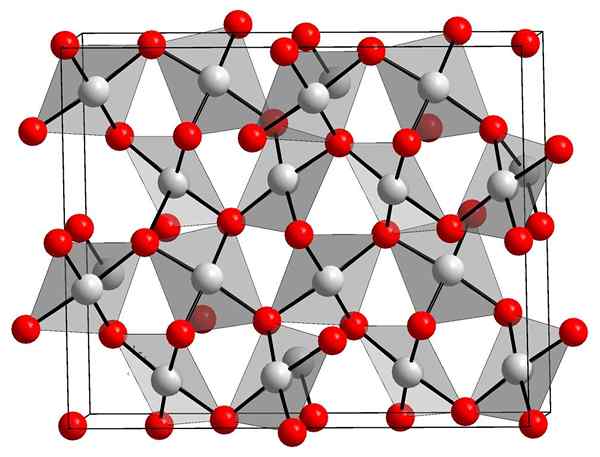
 Kultaoksidikiteinen rakenne. Orci, Wikimedia Commons.
Kultaoksidikiteinen rakenne. Orci, Wikimedia Commons. Yläkuva näyttää kultaoksidin kiteisen rakenteen (III). Kulta- ja happiatomien ja. Vaihtavasti, poista vain au-o-linkit joka tapauksessa.
Kuvan mukaan oletetaan, että kovalenttinen merkki hallitsee (mikä olisi loogista). Tästä syystä esitetään atomit ja linkit, jotka on esitetty palloilla ja palkkeilla. Valkoiset pallot vastaavat kultaatomeja (AUIII-O), ja punertavat happiatomeihin.
Voi palvella sinua: hydroksiapatiittiJos sitä havaitaan huolellisesti, nähdään, että AUO -yksiköitä on4, jotka sitovat happiatomeja. Toinen tapa visualisoida se olisi harkita, että jokainen AU3+ ympäröi neljä tai2-; Tietysti ionisesta näkökulmasta.
Tämä rakenne on kiteinen, koska atomit tilataan noudattamalla samaa pitkän aseman kuviota. Siten sen yhtenäinen solu vastaa rhomboedrista kiteistä järjestelmää (sama kuin ylempi kuva). Siksi kaikki AU2JOMPIKUMPI3 Se voitaisiin rakentaa, jos kaikki nämä yksikkösolun pallot jakautuvat avaruuteen.
Elektroniset näkökohdat
Kulta on siirtymämetalli, ja sen 5D -kiertoradan odotetaan olevan vuorovaikutuksessa suoraan happiatomin 2p -kiertoradan kanssa. Tämän orbitaaliensa päällekkäisyyden teoreettisesti on tuotettava ajo -kaistaleita, jotka tekisivät AU: n2JOMPIKUMPI3 Puolijohde.
Siksi AU: n todellinen rakenne2JOMPIKUMPI3 on vielä monimutkaisempi, kun tämä mielessä.
Hydraatit
Kultainen oksidi voi pitää vesimolekyylejä sen rhombodikaanisten kiteiden sisällä, mikä aiheuttaa hydraatteja. Kun tällaiset hydraatit muodostuvat, rakenteesta tulee amorfinen, ts.
Tällaisten hydraattien kemiallinen kaava voi olla mikä tahansa seuraavista, joita ei itse asiassa ole syvästi selkeitä: AU2JOMPIKUMPI3∙ zh2O (z = 1, 2, 3, jne.), Au (OH)3, tai auxJOMPIKUMPIja(VAI NIIN)z -z.
Au (OH) -kaava3 edustaa näiden hydraattien todellisen koostumuksen yksinkertaistamista. Tämä johtuu siitä, että kultahydroksidissa (III) tutkijat ovat myös löytäneet AU: n läsnäolon2JOMPIKUMPI3; Ja siksi se menettää merkityksen käsitellä sitä erikseen "yksinkertaisena" siirtymämetallihydroksidina.
Voi palvella sinua: Nestemäistä höyryn tasapainoaToisaalta kiinteä Au -kaavaxJOMPIKUMPIja(VAI NIIN)z -z Amorfista rakennetta voitiin odottaa; Koska tämä riippuu kertoimista x, ja ja z -z, joiden variaatiot johtaisivat kaikentyyppisiin rakenteisiin, joilla tuskin pystyi osoittamaan kiteistä kuviota.
Ominaisuudet
Fyysinen ulkonäkö
Se on punertavan ruskea kiinteä.
Molekyylimassa
441,93 g/mol.
Tiheys
11,34 g/ml.
Sulamispiste
Se sulaa ja hajoaa 160ºC: n lämpötilassa. Sillä ei ole kiehumispistettä, joten tämä oksidi ei koskaan kiehu.
Vakaus
Au2JOMPIKUMPI3 Se on termodynaamisesti epävakaa, koska kuten alussa mainittiin, kullalla ei ole taipumusta hapettua normaaleissa lämpötila -olosuhteissa. Niin, että siitä on helppo pelkistettävä jalo kullasta.
Mitä korkeampi lämpötila, sitä nopeampi tämä reaktio on, joka tunnetaan nimellä lämpöhajoaminen. Siten AU2JOMPIKUMPI3 160ºC: n kohdalla se hajoaa tuottamaan metallista kultaa ja vapauttaakseen molekyylin happea:
2 AU2JOMPIKUMPI3 => 4 au + 3 o2
Hyvin samanlainen reaktio voi tapahtua muiden yhdisteiden kanssa, jotka suosivat tätä vähentämistä. Miksi alennus? Koska kulta saa elektronit, jotka happea poistettiin; Mikä on sama kuin kadottaa yhteydet happea.
Liukoisuus
Se on liukenematon kiinteä kiinteä kiinteä. Se on kuitenkin liukoinen suolahapossa ja typpihapoissa, johtuen kultakloridien ja nitraattien muodostumisesta.
Nimikkeistö
Kultaoksidi (III) on nimi, jota hallitsee varastossa nimikkeistö. Muita tapoja mainita se ovat:
-Perinteinen nimikkeistö: Aurinen oksidi, koska Valencia 3+ on suurin kultaa.
-Systemaattinen nimikkeistö: Dioro -trioksidi.
Sovellukset
Lasiväri
Yksi sen merkittävimmistä käytöistä on tarjota punertavaa väriä tietyille materiaaleille, kuten lasille, sen lisäksi.
Voi palvella sinua: vetybromidi (HBR)Auraattien ja fulminant -kullan synteesi
Jos Au lisätään2JOMPIKUMPI3 Elatusaineeseen, jossa se on liukoinen, ja metallien läsnä ollessa se voi saostaa voimakkaan emäksen lisäämisen jälkeen; jotka ovat muodostettu AUO -anionit4- Metallikationien yhtiö.
Myös AU2JOMPIKUMPI3 Reagoi ammoniakin kanssa fulminantti kultayhdisteen, AU: n muodostamiseksi2JOMPIKUMPI3(NH3-A4. Hänen nimensä johtuu siitä, että se on erittäin räjähtävä.
Itse kokoamat monokapas -manipulointi
Kulta ja sen oksidi tiettyjä yhdisteitä ei adsorboitu samalla tavalla, kuten Disulfur Dialil, RSSR. Kun tämä adsorptio tapahtuu, muodostuu spontaanisti Au-S-sidos, jossa rikkitomilla on ja määrittelee mainitun pinnan kemialliset ominaisuudet riippuen funktionaalisesta ryhmästä, johon se on kytketty.
RSSR: ää ei voida adsorboida AU: n yli2JOMPIKUMPI3, Mutta noin metallisesta kullasta. Siksi, jos kullan pinta ja sen hapettumisaste muokataan, samoin kuin AU: n hiukkasten tai kerrosten koko2JOMPIKUMPI3, Heterogeenisempi pinta voidaan suunnitella.
Tämä pinta au2JOMPIKUMPI3-AUSR on vuorovaikutuksessa tiettyjen elektronisten laitteiden metallioksidien kanssa, mikä kehittää tulevaisuuden älykkäämpiä pintoja.
Viitteet
- Kultaoksidit. Toipunut: 911metallurgist.com
- Shi, r. Asahi ja C. Leima. (2007). Kultaoksidien ominaisuudet au2JOMPIKUMPI3 Ja au2O: Ensimmäisen periaatteen tutkimus. Amerikan fyysinen yhteiskunta.
- « Chigualcan Mikä on, ominaisuudet, elinympäristö, käyttö, ominaisuudet
- Hemidesmosomit mikä on, kuvaus, rakenne, toiminnot »

