Titaanioksidi (IV) rakenne, ominaisuudet, käyttää

- 4398
- 512
- Louis Moen
Hän titaanioksidi (IV) Se on kiteinen valkoinen epäorgaaninen kiinteä aine, jonka kemiallinen kaava on setä2, Joten se tunnetaan myös nimellä titaanidioksidi. On olemassa kolmessa kiteisessä muodossa: Rutilo, Anatasa ja Brookita. Vaikka luonteeltaan se on yleensä värillinen epäpuhtauksien, kuten raudan, kromin tai vanadien, setän, setän, esiintymisen vuoksi2 puhdasta käytetään valkoisena pigmentinä.
Sen ominaisuuksista voimme korostaa, että setän liukoisuus2 Se riippuu huomattavasti kemiallisesta ja lämpöhistoriastaan. Samoin kuin kun se lämmitetään korkeissa lämpötiloissa (900 ºC), se muuttuu kemiallisesti inertiksi. Sen tärkeimmät lähteet ovat Ilmeniitti (rauta- ja titaanioksidi), Rutilo ja Anataasi.
 Titaanidioksidipöly. Alkuperäinen lähettäjä oli Walkerma englanninkielisessä Wikipediassa. [Julkinen verkkotunnus]
Titaanidioksidipöly. Alkuperäinen lähettäjä oli Walkerma englanninkielisessä Wikipediassa. [Julkinen verkkotunnus] Se tapahtuu pääasiassa riittävässä määrin käytettäväksi pigmenttinä, mikä takaa sen erinomaiset valonhajautumisominaisuudet sovelluksissa, jotka vaativat valkoista opasiteettia ja kirkkautta.
Sitä esiintyy myös ultrafine -materiaalina sovelluksissa, joissa vaaditaan ultraviolettisäteiden (UV) läpinäkyvyys ja maksimaalinen imeytyminen. Esimerkiksi ihon aurinkovoidetta. Näissä setä2 Se toimii suodattimena, estäen siten näiden säteiden imeytymisen.
Kemiallisen hitauksensa vuoksi se on edullinen valkoinen pigmentti. Yhdysvaltain elintarvike- ja lääkevirasto tai FDA (lyhenne englanniksi TAI.S. Elintarvike- ja lääkehallinto), on perustanut parametrit turvalliseen käyttöön ruokaan ja kosmetiikkaan.
Titaanioksidipölylle on myös raja, koska kun pöly hengitetään, se voidaan kerätä keuhkoihin.
Se voi palvella sinua: calcogens tai amfumos[TOC]
Rakenne
Setä2 Siinä on kolme kiteistä muutosta: Rutilo, Anatasa ja Brookita. Nämä kiteiset lajikkeet ovat luonteeltaan.
Rutilo
Rutho kiteytyy tetragonaalijärjestelmässä kahdella yksiköllä TIO2 jokaiselle solulle. Titanium koordinoituu oktaconisesti. Kalorimetriset tutkimukset on osoitettu, että Rutilo on stabiilin kiteinen muoto.
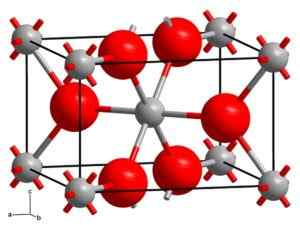 Rutilo -kiteinen rakenne. Harmaat pallot: titaani, vaaleanpunaiset pallot: happi. Solid State [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Lähde: Wikipedia Commons
Rutilo -kiteinen rakenne. Harmaat pallot: titaani, vaaleanpunaiset pallot: happi. Solid State [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Lähde: Wikipedia Commons Anatasa
Tämä muoto kiteytyy tetragonaalijärjestelmässä, mutta anataasi esitetään hyvin vääristyneiden happiatomien muodossa kunkin titaaniatomin suhteen, joista kaksi on suhteellisen lähinnä. On 4 yksikköä setä2 Jokaiselle kiteiselle solulle.
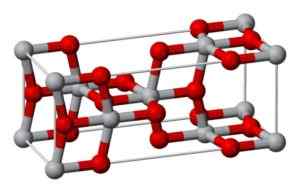 Anataasin kiteinen rakenne. Benjah-BMM27 [julkinen alue] Lähde: Wikipedia Commons
Anataasin kiteinen rakenne. Benjah-BMM27 [julkinen alue] Lähde: Wikipedia Commons Brookita
Kiteytyy ortorromisessa järjestelmässä, 8 yksikköä TIO2 Jokaiselle kiteiselle solulle.
Ominaisuudet
Fyysinen tila
Kiteinen kiinteä.
Mohsin kovuus
Rutilo: 7-7,5.
Anatasa: 5.5-6.
Molekyylipaino
79,87 g/mol.
Sulamispiste
Rutilo: 1830-1850 ºC.
Anatasa: Kun lämmityksestä tulee rutilo.
Tiheys
Rutilo: 4 250 g/cm3
Anatasa: 4 133 g/cm3
Brookita: 3 895 g/cm3
Liukoisuus
Liukenematon vesi- ja orgaanisiin liuottimiin. Se liukenee hitaasti HF: hen ja H2Sw4 Kuuma tiiviste. Liukenematon HCL: ssä ja HNO: ssa3.
PHE
7.5.
Taitekerroin
Rutilo: 2,75 - 550 nm.
Anatasa: 2,54 - 550 nm.
Sillä on korkein taitekerroin kaikista epäorgaanisista pigmenteistä.
Muut ominaisuudet
Anataasi muuttuu nopeasti Rutiloksi yli 700 ºC: n lämpötiloissa. Setä2 joka on kalsinoitu 900 ° C: ssa liuotettu heikosti emäksissä, fluoriarvohapoissa ja kuumassa rikkihapossa. Heikot epäorgaanihapot tai orgaaniset hapot eivät hyökkää siihen. Sitä ei vähennetä tai hapettua helposti.
Se voi palvella sinua: Scandio: historia, ominaisuudet, reaktiot, riskit ja käyttötarkoituksetAnataasi ja ruttil.
Nimikkeistö
-Titaanidioksidi
-Rutilo
-Anatasa
-Brookita
-Titania
Sovellukset
Valkoiset pigmentit
Titaanioksidin (IV) tärkein käyttö on kuin valkoinen pigmentti monissa tuotteissa, joihin kuuluvat maalit, lakka, liimat, muovit, paperit ja tulostusmusteet. Tämä johtuu sen korkeasta taitekertoimesta ja kemiallisesta hitaudesta.
 Lähde: Pexels.com
Lähde: Pexels.com Valkoisena pigmenttinä käytetyllä titaanidioksidilla on oltava korkea puhtaus. Sen opasiteetti ja kirkkaus johtuvat sen kyvystä hajottaa valo. On kirkkaampi kuin timantti. Vain Rutilolla ja anataasilla on hyvät pigmentaatioominaisuudet.
Muovit
Muovissa setä2 Minimoi haurauden ja halkeamisen, joka voi tapahtua valolle altistumisen seurauksena.
Se on tärkein pigmentti ulkoisten PVC -muovisten esineiden valmistuksessa, koska se tarjoaa UV -suojaa materiaalille.
Optimaalinen kiteinen muoto tässä tapauksessa on Rutilo. Tässä sovelluksessa rutilolla on oltava zirkoniumin, piidioksidin tai alumiinin pintapäällyste, jotta setän fotokatalyyttinen vaikutus minimoidaan2 PVC: n hajoamisessa.
Muut käyttötarkoitukset
Muita käyttötarkoituksia ovat sulaan teräs ja raudassa käytettyjä lasimaisia emaleita, jotka antavat opasiteettia ja happoresistenssiä.
Tekstiiliteollisuudessa sitä käytetään lankaoppaissa, niin että ne liukuvat helposti langan aikana. Kitka lankojen ja ohjaiden välillä tuottaa staattista sähköä. Setä hajottaa se2 Se on poltettava nopeudella 1300 ºC, jotta sähköjohtavuus on suurempi.
Voi palvella sinua: litiumfluoridi: rakenne, ominaisuudet, hankkiminen, käyttöMuita sovelluksia ovat mustepigmentaatio tulostukseen. Paperipinnoitteena, setä2 Se tekee siitä valkoisemman, kirkkaamman ja läpinäkymättömän.
Sitä käytetään kosmetiikassa peittämään ihon epätäydellisyydet sekä antamaan valkoinen hammastahna ja saippua.
Se mahdollistaa ruoan, juomien, lisäravinteiden ja lääketuotteiden suojelemisen valon vaikutuksen tuottaman ennenaikaisen hajoamiselta, pidentäen tuotteen käyttöikää.
Se on komponentti lasin, keramiikan ja sähkösuramian tuotannossa. Sitä käytetään sähköpiirielementeissä. Sitä käytetään myös moottoriajoneuvojen pakokaasujärjestelmän happeaanturissa.
Setä2 Ultrafinoa käytetään auringonpohjan komponenttina, koska se on voimakas ultraviolettisäteiden (UV), sekä UV-A että UV-B. UV-A Rays aiheuttaa ryppyjä ja ihon ikääntymistä, ja UV-B aiheuttaa palovammoja ja punoitusta.
Setän nanohiukkaset2 Niitä käytetään kemiallisina reaktioina katalysaattorimateriaalina.
Anataasi on fotokatoiva tehokas, joka hapettaa orgaaniset yhdisteet. Vaikka alaikäiset ovat sen hiukkasia, sitä tehokkaampi se on.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. John Wiley & Sons.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Osa 19 ja 24. Neljäs painos. John Wiley & Sons.
- Kemialliset turvallisuustiedot. (2019). Titaanidioksidi. Talteenotettu: ChemicalSafetyfaktit.org
- Wypych, George. (2015). PVC -lisäaineet. PVC -kaavassa (toinen painos). ScienEdirect.com
- Denning, r. (2009). Villatuotteiden parantaminen nanoteknologiaa käyttämällä. Villatekniikan kehityksessä. ScienEdirect.com
- Lääketieteen kansalliskirjasto. (2019). Titaanidioksidi. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- « Hormonien kilpirauhanen profiilin funktio, merkitys, kvantifiointi
- Chulachaqui -ominaisuudet ja legenda »

