Historiajodi, ominaisuudet, rakenne, hankkiminen, riskit, käytöt

- 4497
- 457
- Joshua Emmerich
Hän jodi Se on reaktiivinen ei -metallinen elementti, joka kuuluu jaksollisen taulukon (halogeenien) ryhmään 17 ja jota edustaa kemiallinen symboli I. Pohjimmiltaan se on hyvin tunnettu elementti suositulla tasolla jodisoidusta vedestä tyrosiinihormoniin.
Kiinteässä tilassa jodi on tummanharmaa metallisella kiiltolla (alempi kuva), joka pystyy sublimointiin tuottamaan violetti höyry, joka tiivistettäessä kylmällä pinnalla jättää tumman jäännöksen. Lukuisat ja houkuttelevat ovat olleet kokeita näiden ominaisuuksien osoittamiseksi.
 Vahva jodikiteitä. Lähde: Benji [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Vahva jodikiteitä. Lähde: Benji [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Bernard Curtois eristi tämän elementin ensimmäistä kertaa vuonna 1811, samalla kun he saivat yhdisteitä, jotka toimivat raaka -aineena Saltpeterin valmistukseen. Curtois ei kuitenkaan tunnistanut jodia elementtiksi, ansioiksi, jotka Joseph Gay-Lussac ja Humphry Davy jakoivat. Gay-Lussac tunnisti elementin "Iode", termi, joka tuli kreikkalaisesta sanasta "Ioides", jonka kanssa violetti väri oli nimetty.
Alkeisjodi, kuten muutkin halogeenit, on diatominen molekyyli, jonka muodostaa kaksi jodiatomia, jotka yhdistyvät kovalenttisella sidoksella. Van der Waalsin vuorovaikutus jodimolekyylien välillä on vahvin halogeenien keskuudessa. Tämä selittää miksi jodi on halogeeni, jolla on suurin sulamis- ja kiehumispisteet. Lisäksi se on vähiten halogeenien reagenssi ja yksi, jolla on vähemmän elektronegatiivisuus.
Jodi on olennainen osa, joka vaatii nautitusta, koska se on välttämätöntä kehon kasvulle; aivojen ja henkinen kehitys; Aineenvaihdunta yleensä jne., suosittelee päivittäistä saannia 110 µg/päivä.
Jodin puute ihmisen sikiön tilassa liittyy kretinismin esiintymiseen, tilaan, jolle on ominaista kehon kasvu; samoin kuin riittämätön henkinen ja älyllinen kehitys, strabismus jne.
Samaan aikaan jodin puute missä tahansa yksilön ikäryhmässä liittyy soittimeen, jolle on ominaista kilpirauhasen liikakasvu. Goiter on endeeminen sairaus, koska se rajoittuu tiettyihin maantieteellisiin alueisiin, joilla on omat ruokaominaisuudet.
[TOC]
Historia
Löytö
Ranskalainen kemisti Bernard Curtois löysi jodin vuonna 1811 työskennellessään isänsä kanssa Salitren tuotannossa, mikä vaatii sitä natriumkarbonaattia.
Tämä yhdiste eristettiin merilevästä, joka kerättiin Normandian rannikolle ja Bretagnelle. Tätä varten levät poltettiin ja tuhka pestiin vedellä, tuhoamalla tuloksena oleva jäte lisäämällä rikkihappoa lisäämällä.
Yhdessä tilanteessa, kenties arvokkaasta virheestä, curtois lisäsi ylimääräistä rikkihappoa ja muodostettiin violetti höyry, joka kiteytettiin kylmillä pinnoilla, kerrostuen tummilla kiteinä. Curtois epäili olevansa uuden elementin läsnäollessa ja kutsui häntä "aineeksi x".
Curtois havaitsi, että tämä aine sekoitettuna ammoniakkiin muodosti ruskean kiinteän aineen (typpitriaruro), joka käytti minimaalista kosketusta.
Curtoisilla oli kuitenkin rajoituksia jatkaa tutkimustaan ja päätti toimittaa päihteiden merkkejä Charles Desormesille, Nicolas Clémentille, Joseph Gay-Lussacille ja André-Marie Ampèrelle, yhteistyön hankkimiseksi saadakseen yhteistyönsä.
Nimen syntyminen
Marraskuussa 1813 Desormes ja Clément julkistivat curtoisin löytämisen. Saman vuoden joulukuussa Gay-Lussac sanoi, että uusi aine voi olla uusi elementti, joka viittaa "iode" -nimeen kreikkalaisesta sanasta "Ioides", nimetty violetiksi.
Sir Humphry Davy, joka sai osan näytteestä Ampèrelle Curtoisissa, teki kokeita näytteestä ja huomasi samankaltaisuuden kloorin kanssa. Joulukuussa 1813 Lontoon Royal Society osallistui uuden elementin tunnistamiseen.
Vaikka Gay-Lussacin ja Davyn välinen argumentti jodin tunnistamisesta syntyi, molemmat tunnustivat, että curtois oli ensimmäinen eristänyt sen. Vuonna 1839 Curtois -finaali.
Historialliset käytöt
Vuonna 1839 Louis Daguerre antoi jodin ensimmäisen kaupallisen käytön keksimällä menetelmän tuottamaan DaguerReotypes -nimisiä valokuvakuvia ohuissa metallilevyissä.
Vuonna 1905 amerikkalainen patologi David Marine tutki jodin puutetta tietyissä sairauksissa ja suositteli hänen saannia.
Fysikaaliset ja kemialliset ominaisuudet
Ulkomuoto
 Jodikiteiden sublimointi. Lähde: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Jodikiteiden sublimointi. Lähde: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Tummanharmaa metallinen kiilto. Kun se sublimoi höyryt, ne ovat violetti väri (ylivoimainen kuva).
Vakioatomipaino
126 904 U
Atominumero (z)
53
Sulamispiste
113,7 ºC
Kiehumispiste
184,3 ºC
Tiheys
Ympäristön lämpötila: 4 933 g/cm3
Liukoisuus
Vedessä se liukenee aiheuttaen ruskeita liuoksia, joiden pitoisuus on 0,03% - 20 ºC.
Tämä liukoisuus kasvaa huomattavasti, jos aiemmin liuenneet jodidi -ioneja on tasapaino I: n välillä vahvistetaan- ja minä2 Anionisten lajien I muodostamiseksi3-, joka on ratkaistu paremmin kuin jodi.
Orgaanisissa liuottimissa, kuten kloroformissa, hiilitetrakloridissa ja hiilidisulfidissa, jodi liukenee purppuran värityksen antaen. Se liukenee myös typpiyhdisteisiin, kuten pyridiini, kinoliini ja ammoniakki, ruskean liuoksen muodostamiseksi, jälleen.
Värityksen ero on siinä, että jodi liuotetaan solvaiduiksi molekyyleiksi I2, tai kun kuorma siirtää komplekseja; Jälkimmäinen ilmestyy, kun he käsittelevät.
Voi palvella sinua: natriumsulfidi (Na2S)Haju
Hehtaarin, ärsyttävä ja ominaisuus. Hajukynnys: 90 mg/m3 ja ärsyttävä hajukynnys: 20 mg/m3.
Oktanoli/vesijakokerroin
Loki p = 2,49
Hajoaminen
Kun hänet kuumennetaan hajoamiseen, hän emittoi vetyjodidien savua ja useita jodidiyhdisteitä.
Goo
2,27 CP 116 ºC: n nopeudella
Kolminkertainen
386,65 K ja 121 kPa
Kriittinen piste
819 K ja 11,7 MPa
Sulamislämpö
15,52 kJ/mol
Höyrystyslämpö
41,57 kJ/mol
Molaarinen kalorikapasiteetti
54,44 J/(mol · k)
Höyrynpaine
Jodilla on kohtalainen höyrynpaine ja kun sisältävä säiliö avataan, se sublimoituu hitaasti violetiksi höyrylle, ärsyttäväksi silmille, nenälle ja kurkkulle.
Hapetusluvut
Jodin hapettumisnumerot ovat: -1 (i-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) ja +7 (i7+-A. Kaikissa jodidisuoloissa KI: n tapaus jodi kohtaa hapettumisnumeron -1, koska meillä on anionia I-.
Jodi saa positiivisia hapettumislukuja yhdistettynä enemmän elektronegatiivisiin elementteihin kuin hän; Esimerkiksi heidän oksideissaan (I2JOMPIKUMPI5 ja minä4JOMPIKUMPI9) tai interhalogenoidut yhdisteet (i-f, i-cl ja i-br).
Elektronegatiivisuus
2.66 Pauling -asteikolla
Ionisaatioenergia
Ensimmäinen: 1.008,4 kJ/mol
Toiseksi: 1.845 kJ/mol
Kolmas: 3.180 kJ/mol
Lämmönjohtokyky
0,449 w/(m · k)
Sähkövastus
1,39 · 107 Ω · m - 0 ºC
Magneettinen järjestys
Diagneettinen
Reaktiivisuus
Jodi yhdistetään useimpiin metalleihin jodidien muodostamiseksi ja myös ei -metallisiin elementteihin, kuten fosforiin ja muihin halogeeneihin. Jodidi -ioni on vahva pelkistävä aine, joka vapauttaa spontaanisti elektronin. Jodidin hapettuminen tuottaa ruskehtavan jodin väriaineen.
Jodi, päinvastoin jodidia, on heikko hapettava aine; heikompi kuin bromi, kloori ja fluori.
Jodi, jolla on hapettumisnumero +1, voidaan yhdistää muiden halogeenien kanssa hapettumisnumero -1: n kanssa, jotta saadaan jodin halpes; Esimerkiksi: jodibromidi. Se yhdistetään myös vedyn kanssa vetyjodidin aiheuttamiseksi, jota veteen liukenemisen jälkeen kutsutaan iarhydiinihapoksi.
Yodhorriini happo on erittäin vahva happo, joka kykenee muodostamaan jodideja reaktiolla metallien tai niiden oksidien, hydroksidien ja karbonaattien kanssa. Jodilla on hapettumistila +5 yodiumhapolla (HIO3), joka on kuivattu tuottamaan jodipentoksidia (I2JOMPIKUMPI5-A.
Elektroninen rakenne ja kokoonpano
- Jodiatomi ja niiden linkit
 Jodidiominen molekyyli. Lähde: Benjah-BMM27 Wikipedian kautta.
Jodidiominen molekyyli. Lähde: Benjah-BMM27 Wikipedian kautta. Jodi perustilassaan koostuu atomista, jossa on seitsemän Valencian elektronia, vain yksi kyvystä suorittaa oktettinsa ja tulla isolektroniseksi jalo ksenonikaasulla. Nämä seitsemän elektronia on järjestetty niiden 5S- ja 5p -kiertoradalle niiden elektronisen kokoonpanon mukaan:
[KR] 4d10 5s2 5 p5
Siksi atomilla minulla on vahva taipumus yhdistää kovalenttisesti niin, että jokaisella erikseen on kahdeksan elektronia sen uloimmassa kerroksessa. Siten kaksi atomia I lähestyvät ja muodostavat I-I-linkin, joka määrittelee diatomisen molekyylin I2 (ylivoimainen kuva); Jodin molekyyliyksikkö kolmessa fysikaalisessa tilassa normaaleissa olosuhteissa.
Kuvassa havaitaan molekyyli I2 edustaa tilan täyttömalli. Se ei ole vain diatominen molekyyli, vaan myös homonukleaarinen ja apolaarinen; Joten sen molekyylien väliset vuorovaikutukset (i2 - Yllyttää2Niitä.
Tämä I-I-linkki on kuitenkin heikompi verrattuna muihin halogeeneihin (F-F, CL-Cl ja BR-BR). Tämä johtuu teoriassa sen SPO: n huonoon päällekkäisyyteen3.
- Kiteet
I: n molekyylimassa2 Se antaa sen dispergoivien voimien olla riittävän suuntainen ja vahva ortorromisen lasin perustamiseksi ympäristön paineessa. Sen korkea elektronipito.
Kuitenkin, kun jodi sublimoi sen höyryt, on violetti väri. Tämä viittaa jo tarkempaan siirtymiseen I: n molekyyliorbitaalien sisällä2 (Ne, joilla on suurempi energiaa tai antenlace).
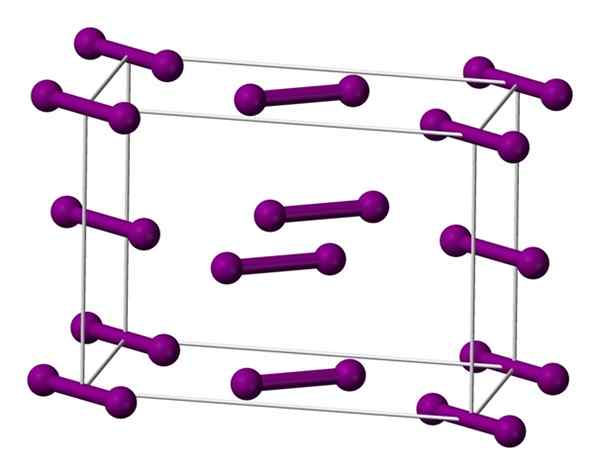 Yhtenäinen ortorrominen solu, joka on keskittynyt jodikristallin pohjaan. Lähde: Benjah-BMM27 [julkinen alue].
Yhtenäinen ortorrominen solu, joka on keskittynyt jodikristallin pohjaan. Lähde: Benjah-BMM27 [julkinen alue]. Molekyylit I on esitetty yllä2, edustaa malli pallo- ja tankojen malli, joka on järjestetty ortorromisen solun sisällä.
Voidaan havaita, että on olemassa kaksi kerrosta: alla olevan viidellä molekyylillä ja väliaineella, jossa on neljä. Huomaa, että jodimolekyyli sijaitsee solun pohjassa. Kide rakennetaan säännöllisesti nämä kerrokset kolmen ulottuvuuden aikana.
Matkustaen I-I-linkkien suuntaisesti suuntautuvaa suuntaa havaitaan, että jodiorbitaalit ovat päällekkäisiä ajokaistan tuottamiseksi, joka palaa tähän elementtiin puolijohde; Sen kykyä johtaa sähkö katoaa kuitenkin, jos kerrosten kohtisuoraa suuntaa noudatetaan.
Linkki etäisyydet
I-I-linkki näyttää viivästyneen; Ja itse asiassa se on, koska sen linkin pituus kasvaa klo 266 pm (kaasumainen tila), 272 pm (kiinteä tila).
Tämä voi johtua siitä, että kaasussa molekyylit I2 He ovat hyvin etäisiä, heidän molekyylien väliset voimat ovat melkein vähäisiä; Kiinteässä kiinteissä voimissa (i-i-i-i) muuttuvat konkreettisiksi, houkuttelemalla kahden naapurimolekyylin jodiatomia itseään kohti ja molekyylien välisen etäisyyden (tai interatomisten, muuten nähtyjen) mukaan) mukaan.
Se voi palvella sinua: kemian suhde muiden tieteiden kanssaSitten, kun sublimaalinen jodilasi, I-I-sidossopimukset kaasufaasissa, koska naapurimaiden molekyylit eivät enää ole samaa vetovoimaa (dispergoiva) ympäristöönsä. Ja myös loogisesti etäisyys i2 - Yllyttää2 kasvaa.
- Vaihe
Edellä mainittiin, että I-I-linkki on heikompi verrattuna muihin halogeeneihin. Kaasufaasissa lämpötilassa 575 ºC, 1% molekyyleistä I2 Ne hajoavat yksilöiksi ja atomiksi. Lämpöenergiaa on niin paljon, että vain kaksi ja uudelleenjoin on erotettu ja niin edelleen.
Samoin tämä linkin rikkoutuminen voi tapahtua, jos jodikiteitä kohdistetaan valtavia paineita. Pakkaamalla sitä liikaa (paineessa satoja tuhansia kertoja korkeampi kuin ilmakehän), molekyylit I2 Ne on järjestetty monoatomisvaiheeksi I, ja sitten sanotaan, että jodia osoittaa metalliominaisuuksia.
On kuitenkin muita kiteisiä faaseja, kuten: vartalokeskeinen orthromi.
Missä se on ja saa
Jodilla on painosopimus suhteessa maankuoreen, 0,46 ppm, miehityspaikka 61. Yoduro -mineraaleja on niukasti, ja kaupallisesti hyödynnetyt jodi -talletukset ovat Yodatos.
Jodi -mineraalit löytyvät niistä kivistä, joiden konsentraatio on 0,02 mg/kg 1,2 mg/kg, ja magmaattisissa kivissä pitoisuuden ollessa 0,02 mg 1,9 mg/kg. Sitä löytyy myös Kimmeridge Lutitasta, pitoisuudella 17 mg/kg painoa.
Lisäksi jodimineraaleja löytyy fosfaattikivistä, joiden pitoisuus vaihtelee välillä 0,8 - 130 mg/kg. Merivedessä on jodipitoisuus, joka vaihtelee välillä 0,1 - 18 ug/l. Levät, sienet ja meriosterit olivat aiemmin tärkeimmät jodin lähteet.
Tärkeimmät lähteet ovat kuitenkin Caliche, natriumnitraattiesiintymiä Atacama -autiomaassa (Chile) ja Salmuelas, lähinnä Japanin kaasukentän Minami Kantossa, Tokion itäpuolella ja Anadarko -kaasukentän altaassa Oklahomassa (USA (USA: n Yhdysvallat. -A.
Caliche
Jodi uutetaan jodinus calichesta ja sitä käsitellään natriumbisulfiittillä sen vähentämiseksi jodidiksi. Sitten liuos reagoi vasta uutetun Yodaton kanssa sen suodatuksen helpottamiseksi. Caliche oli jodin päälähde yhdeksästoista ja 1900 -luvun alkupuolella.
Suolavesi
Puhdistuksen jälkeen suolavesi käsitellään rikkihapolla, joka tuottaa jodidia.
Tämä jodidiliuos reagoi myöhemmin kloorin kanssa laimennetun jodiliuoksen tuottamiseksi, joka haihtuu ilmavirran avulla, joka poikkeaa rikkidioksidin absorboivasta tornista, tuottaen seuraavan reaktion:
Yllyttää2 + 2 h2Tai +niin2 => 2 hi +h2Sw4
Myöhemmin vetyjodidikaasu reagoi kloorin kanssa jodin vapauttamiseksi kaasumaisessa tilassa:
2 Hei +Cl2 => I2 + 2 HCL
Ja lopuksi jodisuodattimet, puhdistukset ja pakkaukset käytettäväksi.
Biologinen paperi
- Suositeltu ruokavalio
Jodi on olennainen tekijä, koska se puuttuu lukuisiin toimintoihin elävissä olennoissa, jotka ovat erityisen tunnettuja ihmisillä. Ainoa jodin sisäänpääsytapa ihmiselle ovat hänen nauttimansa elintarvikkeet.
Suositeltu jodiruokavalio vaihtelee iän mukaan. Siten 6 kuukauden ikäinen poika vaatii saannin 110 ug/päivä; Mutta 14 -vuotiaasta lähtien suositeltu ruokavalio on 150 ug/päivä. Lisäksi todetaan, että jodin saanti ei saisi ylittää 1.100 µg/päivä.
- Kilpirauhashormonit
Kilpirauhasen stimuloiva hormoni (TSH) erittyy aivolisäkkeen avulla ja stimuloi jodia kilpirauhasen follikkeleilla. Jodia kuljetetaan kilpirauhanen follikkelien sisällä, joka tunnetaan kolloideina, missä se sitoutuu aminohappotyrosiiniin muodostaen monoyodotyrosiinia ja diiodotyrosiinia.
Follikulaarisessa kolloidissa monoyodirosiini3-A. Toisaalta voidaan liittää kaksi diiodotyrosiinimolekyyliä, muodostaen tetrarydotyronin (t4-A. T -t3 ja T4 Ne ovat niin kutsuttuja kilpirauhashormoneja.
Hormonit T3 ja T4 Ne erittyvät plasmaan, missä he sitoutuvat plasmaproteiineihin; Niiden joukossa kilpirauhashormonien kuljetinproteiini (TBG). Useimmat kilpirauhashormonit kuljetetaan plasmassa kuin t4.
Kilpirauhashormonien aktiivinen muoto on kuitenkin t3, Joten t4 Kilpirauhashormonien "valkoisissa elimissä", kokemukset ja muuttuvat T: ksi3 Hormonaalisen toiminnan käyttäminen.
Vaikutukset
Kilpirauhashormonien vaikutukset ovat useita, kykeneviä huomauttamaan seuraavat: aineenvaihdunnan ja proteiinisynteesin lisääntyminen; kehon kasvun ja aivojen kehityksen edistäminen; Lisääntynyt verenpaine ja syke jne.
- Puute
Kilpirauhashormonien jodin ja siten kilpirauhasen vajaatoiminnan puutoksella on lukuisia seurauksia, joihin ihmisen ikä vaikuttaa.
Jos jodin puutos tapahtuu henkilön sikiön tilan aikana, merkityksellisin seuraus on kreatinismi. Tälle tilalle on ominaista merkkejä, kuten henkisen toiminnan heikkeneminen, fyysisen kehityksen viivästyminen, strudismi ja myöhäinen seksuaalinen kypsyminen.
Voi palvella sinua: kupari: historia, ominaisuudet, rakenne, käyttö, biologinen paperiJodin puute voi indusoida soittimen riippumatta iästä, jolla puute tapahtuu. Goiter on liiallinen kilpirauhasen kehitys, joka johtuu TSH -hormonin rauhanen liiallisesta stimulaatiosta, joka vapautetaan aivolisäkkeen rauhasesta jodin puutoksen seurauksena.
Kilpirauhasen liiallinen koko voi puristaa henkitorven, rajoittaen ilman kulkua sen läpi. Lisäksi se voi vahingoittaa kurkunpään hermoja, joilla voi olla rommi.
Riskejä
Liiallisen jodin saannin aiheuttama myrkytys voi aiheuttaa palovammoja suussa, kurkussa ja kuumeessa. Myös vatsakipu, pahoinvointi, oksentelu, ripuli, heikko pulssi ja kooma.
Ylimääräinen jodia tuottaa joitain puutteessa havaittuja oireita: Kilpirauhashormonien synteesi estävät, joten TSH: n vapautuminen kasvaa, mikä johtaa kilpirauhasen hypertrofiaan; eli soittaja.
On olemassa tutkimuksia, jotka osoittavat, että liiallinen jodin saanti voi aiheuttaa kilpirauhasen papillaarisyövän. Lisäksi liiallinen jodin saanti voi olla vuorovaikutuksessa lääkkeiden kanssa rajoittamalla sen vaikutusta.
Liiallisella jodisotaalla vajaatoimintalääkkeillä, kuten metimatsolilla, jota käytetään kilpirauhasen hoitoon, voi olla additiivinen vaikutus ja aiheuttaa kilpirauhasen vajaatoiminta.
Angiotensiini (ECA) muuntaa entsyymi -estäjiä, kuten benazeprilia, käytetään verenpaineen hoidossa. Liiallisen määrän kaliumjodidin ottaminen lisää hyperkalemian ja verenpaineen riskiä.
Sovellukset
Lääkärit
Jodi toimii ihon tai haavojen desinfiointiaineena. Sillä on melkein tilannekuva antimikrobinen vaikutus, joka tunkeutuu mikro -organismeihin ja vuorovaikutuksessa rikki -aminohappojen, nukleotidien ja rasvahappojen kanssa, mikä aiheuttaa solukuoleman.
Se käyttää viruksenvastaisia vaikutuksiaan pohjimmiltaan peitettyihin viruksiin, postulaatioon, joka hyökkää peitettyjen virusten pintaan.
Kaliumjodidia konsentroituneessa liuoksessa käytetään tyrotoksikoosin hoidossa. Sitä käytetään myös säteilyn vaikutusten hallintaan 131I estäen radioaktiivisen isotooppin liiton kilpirauhaselle.
Jodia käytetään dendriittisen keratiitin hoidossa. Tätä varten sarveiskalvo on tyydyttyneen veden höyryt jodilla, sarveiskalvon epiteeli häviää väliaikaisesti; Mutta se on täydellinen palautus kahdessa tai kolmessa päivässä.
Jodilla on myös hyödyllisiä vaikutuksia ihmisen sinusfibroosin hoitoon. Samoin on huomautettu, että 131Voisin olla valinnainen kilpirauhassyövän hoito.
Reaktiot ja katalyyttinen vaikutus
Jodia käytetään tärkkelyksen läsnäolon havaitsemiseen, mikä antaa sinisen värin. Jodin reaktiota tärkkelyksen kanssa käytetään myös tärkkelystä sisältävien väärien lippujen läsnäolon havaitsemiseksi.
Kalium (II) tetrayodomercuraattia, joka tunnetaan myös nimellä Nessler -reagenssi, käytetään ammoniakin havaitsemisessa. Samoin jodomormikokeessa käytetään alkalisen jodiliuosta metyylisiskurin esiintymisen osoittamiseksi.
Epäorgaaninen jodidi. Prosessin vaiheessa näiden metallien tetrayodurot on muodostettava.
Jodi toimii stabilisaattorina Colfonialle, öljylle ja muille puutuotteille.
Jodia käytetään katalyyttinä metylaation orgaanisissa synteesireaktioissa, isomeroitumisessa ja dehydrafaation yhteydessä. Sillä välin iarchloriinihappoa käytetään katalysaattorina etikkahapon tuottamiselle Monsanto- ja Cativa -prosesseissa.
Jodi toimii katalysaattorina aromaattisten amiinien kondensoitumisessa ja alposaatiossa sekä sulfatization- ja sulfanaatioprosesseissa sekä synteettisten kumien tuotannossa.
Valokuvaus ja optiikka
Silver Yoduro on olennainen osa perinteistä valokuvaelokuvaa. Jodia käytetään elektronisten instrumenttien, kuten ainutlaatuisten lasiprismien, optisten instrumenttien, valmistuksessa ja lasi, joka pystyy lähettämään infrapunasäteitä.
Muut käyttötarkoitukset
Jodia käytetään torjunta -aineiden, aniliini- ja phtaleína -väriaineiden kehittämisessä. Lisäksi sitä käytetään väriaineiden synteesissä, ja se on savua sammuttava aine. Ja lopuksi, hopeajodidi toimii ytimenä vesihöyryn tiivistymisestä pilvissä, sateen aiheuttamiseksi.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Stuart Ira Fox. (2003). Ihmisen fysiologia. Ensimmäinen painos. Muokata. McGraw-Hill-Amerikanvälinen
- Wikipedia. (2019). Jodi. Haettu: vuonna.Wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi ja Onoda Mitsuko. (2003). Kiinteän jodin moduloitu strupture sti -molekyylin dissosiaation UND: n aikana. Luonnon osa 423, sivut971-974. doi.org/10.1038/Nature01724
- Chen l. et al. (1994). Jodin rakenteelliset vaihesiirtymät korkeassa paineessa. Fysiikan instituutti, Sinica Academy, Peking. doi.org/10.1088/0256-307x/11/2/010
- Stefan Schneider ja Karl Christe. (26. elokuuta 2019). Jodi. Encyclopædia britannica. Toipunut: Britannica.com
- DR. Doug Stewart. (2019). Jodi -elementti tosiasiat. Kemikooli. Toipunut: Chemicool.com
- Kansallinen bioteknologiatietojen keskus. (2019). Jodi. Pubchem -tietokanta. CID = 807. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Rohner, f., Zimmermann, M., Jooste, P., Pandav, c., Caldwell, K., Raghavan, r., & Raiten, D. J -. (2014). Ravitsemuksen biomarkkerit kehitys-jodikatsaukseen. The Journal of Nutrition, 144 (8), 1322S-1342s. Doi: 10.3945/JN.113.181974
- Kannattaa. (2019). Jodi. Kemia selitetty. Palautettu: Chemistry Explaed.com
- Traci Pedersen. (19. huhtikuuta 2017). Faktoja jodista. Toipunut: LivesCience.com
- Megan Ware, Rdn, LD. (30. toukokuuta 2017). Kaikki mitä sinun tarvitsee tietää jodista. Toipunut: MedicalNewstody.com
- Kansallinen terveysinstituutti. (9. heinäkuuta 2019). Jodi. Haettu: SDG.Od.NIH.Hallitus
- « Kriptonin historia, ominaisuudet, rakenne, hankkiminen, riskit, käyttää
- Mary Celeste -edeltäjät, tapahtumat, teoriat »

