Kaliumjodidi (KI) -rakenne, ominaisuudet, hankkiminen, käyttö, riskit

- 698
- 83
- Sheldon Kuhn
Hän kaliumjodidi Se on epäorgaaninen yhdiste, jonka muodostaa kaliumioni (k+) ja jodidi -ioni (i--A. Sen kemiallinen kaava on ki. Se on valkoinen kiteinen kiinteä, ioninen luonne ja se on hyvin liukoinen veteen.
KI sallii useita kemiallisia reaktioita ja -analyysiä, ja sitä käytetään otsonin määrän mittaamiseen ilmakehässä. Sitä käytetään myös infrapunanalyysilaitteissa (IR).
 Kiinteä ki kaliumjodidi. Ondřej Mangl [julkinen alue]. Lähde: Wikimedia Commons.
Kiinteä ki kaliumjodidi. Ondřej Mangl [julkinen alue]. Lähde: Wikimedia Commons. Kaliumjodidia lisätään yleiseen pöytäsuolaan jodin puutoksen estämiseksi ihmisillä, koska tämä voi muodostaa vakavan terveysongelman.
Sitä käytetään odotustena, koska se auttaa, että lima voi virtaa helposti hengityskanavista ulkopuolella. Se myös hoitaa joitain sieni -infektioita ja sitä käytetään joissain kosmetiikassa.
Eläinlääkärit käyttävät sitä parantamaan eläimiä, jotka ovat samanlaisia kuin ihmisten, kuten yskä ja iho -infektiot. Sitä lisätään jopa hyvin pieninä määrinä eläimille eläimille.
[TOC]
Rakenne
Kaliumjodidi on ioninen yhdiste, joka on muodostettu kaliumkationilla k+ Ja Yoduro I -anionin-, Siksi niiden välillä linkki on ioninen. Kaliumhapetustila on +1 ja Valencia del -jodi on -1.
 Kaliumjodidi on ioninen yhdiste. Kirjoittaja: Marilú Stea.
Kaliumjodidi on ioninen yhdiste. Kirjoittaja: Marilú Stea. Ki -kaliumjodidikiteet ovat kuutiometriä.
 Ki -kaliumjodidin rakenne. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
Ki -kaliumjodidin rakenne. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Nimikkeistö
- Kaliumjodidi
- Kaliumjodidi
Ominaisuudet
Fyysinen tila
Kiteinen valkoinen kiinteä aine. Kuutiokiteet.
Molekyylipaino
166 003 g/mol
Sulamispiste
681 ºC
Kiehumispiste
1323 ºC
Tiheys
3,13 g/cm3
Liukoisuus
Hyvin liukoinen veteen: 149 g/100 g vettä 25 ° C: ssa. Liukenee hieman etanoliin ja eetteriin.
Voi palvella sinua: Neon: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetPHE
Sen vesipitoiset liuokset ovat neutraaleja tai emäksisiä, pH: n välillä 7 - 9.
Kemialliset ominaisuudet
Hieman hygroskooppinen kosteassa ilmassa.
Se on vakaa kuiva ilmassa. Valo ja kosteus kiihdyttävät sen hajoamista ja sen värimuutokset keltaiseksi pienten jodin vapautumisen vuoksi (I2) ja Yodatos (IO3--A.
Ki -vesiliuokset muuttuvat myös ajan myötä, mutta pienellä alkalilla tämä voidaan välttää.
Nämä ratkaisut liukenevat jodiin (i2) KI: n antaminen3-
Yllyttää- + Yllyttää2 → I3-
Muut ominaisuudet
Sillä on voimakkaasti katkera ja suolaliuos. Se ei ole syttyvä.
Saada
Kaliumjodidi voidaan saada kuumentamalla jodia (i2) Kaliumhydroksidin (KOH) konsentroituneessa liuoksessa:
3 i2 + 6 KOH → 5 Ki + KIO3 + H2JOMPIKUMPI
Tuloksena oleva yodato- ja jodidiliuos lämmitetään veden poistamiseksi, se pelkistetään kuivuudeksi, hiili lisätään ja lämmitetään korkeassa lämpötilassa. Hiili vie happea jodaista ja hapettaa hiilidioksidin vähentäen siten jodidia jodidiksi:
2 Kio3 + C → 2 Ki + 3 Co2
Saatu kaliumjodidi voidaan kiinnittää uudelleen sen puhdistamiseksi. Toisin sanoen se löydetään uudelleen vedessä ja saa kiteytymään uudelleen.
Sovellukset
Kilpirauhasen hoidossa
Kaliumjodidi toimii lisäkäsittelynä yhdessä muiden kilpirauhasen vastaisten aineiden kanssa hypertyreoosia hoitamiseksi.
Hypertyroosi on sairaus, joka saa kilpirauhanen tuottamaan liikaa kilpirauhashormonia, lisääntyneen kilpirauhasen koon kanssa, vähentynyt ihmisen paino, kiihtynyt syke ja ärtyneisyys, muun muassa oireiden joukossa.
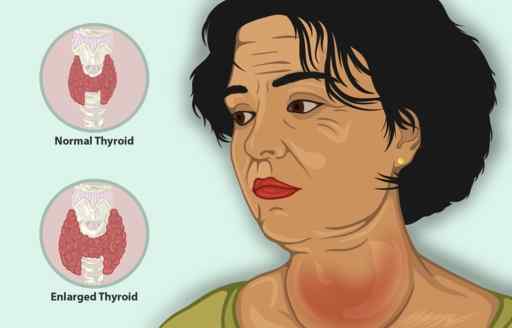 Nainen, jolla on tulehtunut kilpirauhasen. Sitä voidaan käsitellä ki kaliumjodidilla. https: // www.Myupchar.com/in [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Nainen, jolla on tulehtunut kilpirauhasen. Sitä voidaan käsitellä ki kaliumjodidilla. https: // www.Myupchar.com/in [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Potilailla, joilla on kilpirauhasen vajaatoiminta, KI vähentää nopeasti oireita, koska se estää kilpirauhashormonin vapautumista.
Sen kilpirauhasen vaikutukset ovat: rauhanen verisuonten määrän vähentäminen, kudosten vahvistaminen ja solujen koon pienentäminen.
Tästä syystä sitä sovelletaan preoperatiivisena kohteluna kilpirauhasen koon indusoinnista tai pienenemisestä ennen kilpirauhasen (kilpirauhanpoistoa), koska tätä operaatiota helpotetaan.
Voi palvella sinua: Natrium: Historia, rakenne, ominaisuudet, riskit ja käyttötarkoituksetMuissa lääketieteellisissä sovelluksissa
Kaliumjodidilla on odotettavissa olevia ominaisuuksia, kun hengitysnesteiden eritys kasvaa, mikä johtaa vähentyneeseen liman viskositeettiin.
 Kaliumjodidi voi toimia odotuksena yskähoitoon. Kirjailija: анастаball геп. Lähde: Pixabay.
Kaliumjodidi voi toimia odotuksena yskähoitoon. Kirjailija: анастаball геп. Lähde: Pixabay. Se palvelee Nodoso -erytheman hoitoa, joka on tuskallinen tulehdus jaloissa, joissa muodostetaan punatut kyhmyjä ja lisääntynyttä lämpötilaa.
On antihongos -agentti. Se mahdollistaa sporotroosin hoitamisen, joka on sienen aiheuttama iho -infektio. Tämä tauti tapahtuu ihmisille, jotka työskentelevät kasvien ja maan kanssa, kuten viljelijät ja puutarhurit.
Sitä käytetään myös jodin puutoksen käsittelyssä tai sen välttämiseksi, ja siksi se lisää pöytäsuolaa tai syötävää suolaa (natriumkloridi NaCl) jodin lähteenä ja joskus vedessä juomaan.
Eläinlääketieteellisissä sovelluksissa
Kaliumjodidia annetaan eläimille antitutiivisina, hengitysteiden nesteiden lisäämiseksi ja nesteyttämiseksi, keuhkoputken kroonisen yskän, samoin kuin reuman tapauksissa ja anti -inflammatorisena.
Se palvelee myös eläinten mykoosia (sieni -infektioita) kutinaa ja kroonista lyijyä tai elohopeamyrkytystä varten.
Kilpirauhanen suojaamisessa radioaktiivisissa hätätilanteissa
Kaliumjodidilla on kilpirauhasen suojaominaisuudet, jos henkilö on altistunut ydinsäteilylle.
KI tulvii kilpirauhanen ei -radioaktiivisella jodilla estäen siten radioaktiivisten molekyylien ottamisen ja radioaktiivisen jodin imeytymisen suojaamalla kilpirauhanen syöpään, joka voi aiheuttaa säteilyä.
Otsonimittauksissa ilmakehässä
Otsonikaasu (tai3;.
Voi palvella sinua: Benchilo -bentsoaattiNämä elektrolyyttiset solut sisältävät Ki -kaliumjodidiliuoksen. Solut ovat alun perin kemiallisessa ja sähköisessä tasapainossa.
Kun ilman näyte otsonilla (tai3) Tunkeutuu johonkin soluista tasapaino, koska seuraava reaktio tapahtuu:
2 Ki + tai3 + H2O → i2 + JOMPIKUMPI2 + 2 Koh
Tämä reaktio tuottaa sähkövirran, joka virtaa solujen välillä.
Radioaallot siirretään jatkuvasti tuotetun sähkövirran määrä asemaan maalla. Tällä tavoin saadaan otsoniprofiili, joka on maasta pallon korkeuteen.
 Ilmapallo -off Radiosondan kanssa KI: n kanssa otsonin mittaamiseksi. Hannes Grobe 19:27, 20. kesäkuuta 2007 (UTC), Alfred Wegener Polar and Marine Research -instituutti, Bremerhaven, Saksa [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/2.5)]. Lähde: Wikimedia Commons.
Ilmapallo -off Radiosondan kanssa KI: n kanssa otsonin mittaamiseksi. Hannes Grobe 19:27, 20. kesäkuuta 2007 (UTC), Alfred Wegener Polar and Marine Research -instituutti, Bremerhaven, Saksa [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/2.5)]. Lähde: Wikimedia Commons. Useissa käyttötarkoituksissa
Kaliumjodidi sallii myös:
- Vapaiden radikaalien, kuten hydroksyyliradikaalin OH, eliminointi.
- Valokuvaemulsioiden valmistus hopean saostamiseksi.
- Paranna eläinsyöttöä, kun lisätään mikrokonttoisuuksia.
- Karjan lannoite deodorisoi.
- Lähetä infrapunaspektrin valo IR -analyysilaitteissa.
- Suorita tietyt kemialliset reaktiot ja analyysi kemian laboratorioissa.
- Käytä sitä henkilökohtaisissa hygieniatuotteissa.
- Suorita ympäristön pilaantumisanalyysi.
Riskejä
Jotkut ihmiset, jotka ovat herkkiä jodidille.
Tuberkuloosi- tai akuutin keuhkoputkentulehduksen ihmisten tulisi myös olla varovaisia.
KI voi aiheuttaa sylkirauhasten pehmenemistä, se voi polttaa suun tai kurkun, epätavallisen syljenergian, hammaskivun ja ikenien tulehduksen ja metallisen maun tulehduksen.
Voit myös ärsyttää silmiä ja avata haavat iholla.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Kaliumjodidi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Neljäs painos. John Wiley & Sons.
- Dean, J.-Lla. (Toimittaja). (1973). Langen kemian käsikirja. Elementh Edition. McGraw-Hill Book Company.
- Valkovic, v. (2019). Säteilyaltistuksen jälkeen puhdistaminen. Herkimmat ruumiinosat. Radioaktiivisuudessa ympäristössä (toinen painos). ScienEdirect.com.
- Sm, h.G.J -. (2015). Kemian ilmakehän havainnointien kemia (in situ). Ilmakehän tietosanakirjassa (toinen painos). ScienEdirect.com.
- Muralikrishna, I.V. ja Manickam, V. (2017). Analyyttiset menetelmät ympäristökyselyjen seurantaan. Ympäristöhallinnassa. ScienEdirect.com.
- Wallace, J.M. ja Hobbs, P.V. (2006). Ilmakehän kemia 1. Ilmakehän tieteessä (toinen painos). ScienEdirect.com.
- « Valtion tyyppien ja niiden ominaisuuksien muutokset (esimerkkien kanssa)
- Dekantointikonsepti, esimerkit ja tyypit »

