Elektroninen affiniteetti

- 3523
- 1024
- Joshua Emmerich
Mikä on elektroninen affiniteetti?
Se Elektroninen affiniteetti Se määritellään energian määräksi, joka vapautuu, kun kaasumaisessa tilassa atomien mooli yhdistetään elektronien mooliin anionien moolin muodostamiseksi, myös kaasumaisessa tilassa. Toisin sanoen se viittaa seuraavan prosessin entalpian vaihtelun negatiiviseen:
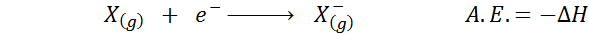
Kuten nimestä voi päätellä, elektroninen affiniteetti (a.JA.) Trendistä on mitta, jolla on atomi liittyä elektroniin. Eli se mittaa atomin affiniteettia elektroneille.
Elektronisen affiniteetin tulkinta
Sen määritelmän takia korkea elektroninen affiniteetti tarkoittaa, että entalpian variaatio on erittäin negatiivinen. Tämä puolestaan osoittaa, että prosessi on energisesti suotuisa ja että tuotteet ovat vakaampia kuin reagenssit. Tästä syystä voimme myös sanoa, että elektroninen affiniteetti on epäsuora mitta anionin stabiilisuudesta.
Mitä suurempi atomin elektroninen affiniteetti, sitä suurempi suuntaus on muodostaa anionia. Siksi atomit, kuten kloori, jonka elektroninen affiniteetti on 349 kJ/mol, muodostuvat yleensä anionit helposti (tässä tapauksessa kloridianioni), kun taas muut atomit, kuten magnesium, joiden elektroninen affiniteetti on negatiivista, eivät muodosta anioneja.
Selvennys elektronisesta affiniteetista ja ionisaatioenergiasta
Monta kertaa ajattelet elektronista affiniteettia vastakohtana ionisaatioenergialle (kaasumaisen atomin taipumus menettää elektronia), mutta tämä ei ole niin. Harkitse esimerkiksi atomia x.
Se voi palvella sinua: Tusfrano: kemiallinen rakenne, ominaisuudet ja käytötSen sähköinen affiniteetti viittaa edellä esitetyn prosessin energian muutokseen ensimmäisessä yhtälössä. Sen ionisaatioenergia viittaa kuitenkin energian muutokseen, kun atomi menettää elektronin:
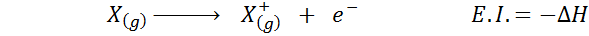
Vaikka tämä reaktio näyttää olevan päinvastainen reaktio edelliseen.
Mikä määrittää elektronisen affiniteetin?
Tietämään, mitkä atomin ominaisuudet vaikuttavat sen elektronisen affiniteetin arvoon, alkuperäisen atomin stabiilisuutta on harkittava sekä muodostetun anionin arvoa. Jos anioni on vakaampi kuin atomi, niin elektroninen affiniteetti on korkea, muuten se on alhainen tai jopa negatiivinen.
Mutta miten tietää, mikä kahdesta lajista on vakaampi? Sitä varten luotamme kahteen tekijään:
- Elektroninen kokoonpano. Sähköisiä asetuksia on enemmän kuin muut. Yleensä koko kerroksen kokoonpano (kuten jalokaasut) on kaikkein vakain. Sitten sitä seuraa puolikilven kerroskonfiguraatio, jossa kaikilla Valencia-kerroksen kiertoradalla on puolet elektroneista, joita heillä voi olla (esimerkiksi 4S14P3-A.
- Elektroninen torjuminen. Jos verrataan kuorma -anionia -1, kuormitusanionin -2: lla, toisessa tapauksessa elektronien välillä on paljon enemmän torjuntaa, joka destabiloi anionia.
Säännöllinen elektroninen affiniteetti taipumus
 Kaavio, joka näyttää jaksollisen taulukon 9 ensimmäisen elementin elektroniset sukulaisuudet
Kaavio, joka näyttää jaksollisen taulukon 9 ensimmäisen elementin elektroniset sukulaisuudet Elektroninen affiniteetti on yksi elementtien jaksollisista ominaisuuksista. Eli se on ominaisuus, joka vaihtelee ennustettavasti elementistä toiseen riippuen sen sijainnista jaksollisessa taulukossa. Yleisesti ottaen elektroninen affiniteetti kasvaa, kun atomin koko pienenee.
Se voi palvella sinua: puoliksi kehitetty kaava: Mikä on ja esimerkkejä (metaani, propaani, butaani ...)Tässä mielessä atomien koko vaihtelee ajanjakson ja ryhmän mukaan, jolla se sijaitsee, joten sen elektroninen affiniteetti vaihtelee myös alla selitetyksi:
Elektronisen affiniteetin vaihtelu ajanjaksolla
Ainakin edustavien elementtien (jaksollisen taulukon S- ja P -lohkoihin kuuluvat) voidaan havaita, että elektronisella affiniteetilla on yleinen taipumus kasvaa vasemmalta oikealle johtuen tehokkaan ydinkuorman lisääntymisen vuoksi, joka pystyy houkuttelemaan elektroneja suuremmalla voimalla.
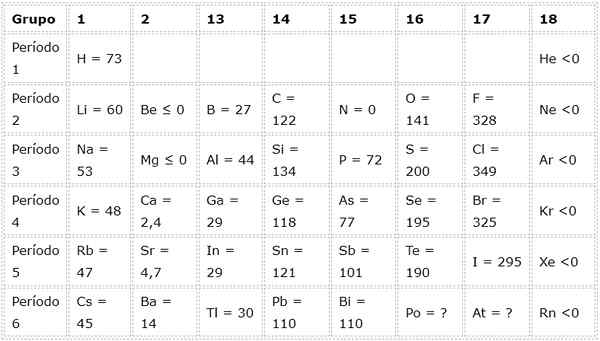
Esimerkiksi, jos otamme jaksollisen taulukon kolmannen ajanjakson, voimme nähdä, että LI: n elektroninen affiniteetti (60 kJ/mol) on pienempi kuin happea (141 kJ/mol) ja tämä on pienempi kuin fluoridi (328 kJ /mol).
Poikkeukset
Edellinen sääntö ei aina täytetä.
Ensinnäkin, kun siirryt alkalimetalleista alkaliiniin, elektroninen affiniteetti vähenee. Tämä johtuu siitä, että alkalimetallit (NS Elektroninen kokoonpano1) Elektronin sieppaaminen on suotuisaa, koska he lopettaisivat heidän kiertoradansa täyttämisen.
Alkalerosin tapauksessa (elektroninen kokoonpano NS2) elektronin sieppaaminen on epäsuotuisaa, koska heillä on jo täysi kiertorada. Sama tapahtuu siirtyessä halogeeneistä (joilla on kaikkien elementtien elektroniset sukulaisuudet) jalokaasuihin.
Elektronisen affiniteetin vaihtelu koko ryhmässä
Ryhmien tapauksessa käyttäytyminen on vielä vähemmän ennustettavissa. Yleinen sääntö on, että a.JA. kasvaa alhaalta ylöspäin, samaan suuntaan, joka vähentää atomin sädettä. Alkali- ja halogeenimetalleille tämä sääntö täyttyy melko hyvin. Tätä ei kuitenkaan tapahdu useimpien muiden ryhmien kanssa.
Voi palvella sinua: koboltihydroksidiEsimerkkejä joidenkin edustavien elementtien elektronisesta affiniteetista
Seuraava taulukko näyttää elektroniset affiniteettiarvot (kj/mol) Edustavat elementit Lajiteltu ryhmän mukaan:
Alla on joitain esimerkkejä elektronisesta affiniteetista yhdessä sen reaktion kanssa, johon he viittaavat:
1. Vety elektroninen affiniteetti
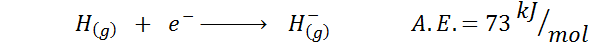
2. Elektroninen happea -affiniteetti
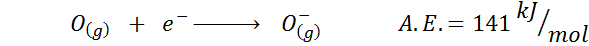
3. Anionin elektroninen affiniteetti
Toinen yleinen esimerkki on anionin elektroninen affiniteetti, kuten tai-. A.JA. Tässä tapauksessa se antaa seuraavaan prosessiin liittyvä energia:
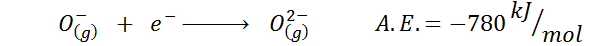
Kuten voidaan nähdä, tämä elektroninen affiniteetti on voimakkaasti negatiivinen, vaikka ioni tai2- Siinä on elektroninen neonkokoonpano (jalo kaasu) ja se on hyvin yleinen ioni monissa ionisissa kiinteissä aineissa.
Syynä on, että negatiivisten maksujen torjuminen tai2- Destabilisoi tämän kaasumaisen tilan ionin, mutta kiinteä tilassa sitä ympäröivät kationit stabiloivat kuorman.

