Arseenihistoria, rakenne, ominaisuudet, käytöt

- 3289
- 812
- Kelly Kilback
Hän arseeni Se on puolimetaali tai metalloidi, joka kuuluu ryhmälle 15 tai menee jaksollisesta taulukosta. Sitä edustaa kemiallinen symboli AS, ja siinä on atominumero 33. Se voi olla alle kolme allotrooppista muotoa: keltainen, musta ja harmaa; Jälkimmäinen on ainoa teollisuuden merkitys.
Harmaa arseeni on metallinen, herkän näköinen kiinteä kiinteä kiinteä kiinteä ja kiteinen väri (alempi kuva). Menettää kirkkauden, kun se altistetaan ilmaa muodostaen arseniososoksidia (kuten2JOMPIKUMPI3), joka lämmitettyä säteilee valkosipulin hajua. Toisaalta sen keltaiset ja mustat alotrochot ovat vastaavasti molekyyli- ja amorfisia.
 Metallinen arseeni. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]
Metallinen arseeni. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Arseeni sijaitsee maankuoressa, joka liittyy lukuisiin mineraaleihin. Vain pieni osa on alkuperäisessä tilassa, vaikka se liittyy antimoniin ja hopeaan.
Yleisimpiä mineraaleja, joissa arseeni on seuraava: rejalgar (AS4S4), oropimentti (kuten2S3), Lollingita (ruma2) ja Enargita (Cu3Perse4-A. Arseeni saadaan myös metallien, kuten lyijyn, kuparin, koboltin ja kultaa, vakuustuotteena.
Arseeniyhdisteet ovat myrkyllisiä, etenkin Arsina (tuhka3-A. Arseenilla on kuitenkin lukuisia teollisuussovelluksia, mukaan lukien lyijy -seos, jota käytetään autoparistojen kehittämisessä, ja seos galliumin kanssa, jolla on useita käyttötarkoituksia elektroniikassa.
[TOC]
Löytösi historia
'Arseeni' -nimi on peräisin latinalaisesta arsenicumista ja kreikkalaisesta Arsenikonista, viitaten keltaiseen oropimenttiin, joka muodosti alkemistien pääaarseenin käytön päämuodon,.
Arseeni kauan ennen kuin se tunnistetaan kemialliseksi elementiksi, tunnettiin ja sitä käytettiin sen yhdisteiden muodossa. Esimerkiksi Aristoteles neljännellä vuosisadalla.C. Hän kirjoitti Sandarachesta, aineesta, jonka nyt ajatellaan, että se oli arseenisulfidi.
Plinio El Viejo ja Pivanio Discorides, 1. vuosisadalla.C., He kuvasivat oropimentin, mineraalin, jonka muodostuu2S3. Yhdennentoista vuosisadan aikana tunnistettiin kolme arseenilajia: valkoinen (kuten4JOMPIKUMPI4), Keltainen (kuten2S3) ja punainen (kuten4S4-A.
Albertus Magnus havaitsi arseenin puhtaana elementtinä ensimmäistä kertaa (1250). Magnus -lämmitetty arseenisulfidi saippualla, huomaa aineen ulkonäön, jolla on ominaisuus, joka on samanlainen kuin kuvan harmaa -kiehuva kuva. Ensimmäisen aito raportin sen eristyksestä julkaisi kuitenkin vuonna 1649 saksalainen apteekki Johann Schroeder.
Schroeder valmisti arseenin lämmittämällä hiilioksidia. Myöhemmin Nicolas Lémery onnistui lämmittämään sen lämmittämällä arseenioksidin, saippuan ja potaskan seosta. 1800 -luvulla tämä elementti tunnustettiin lopulta puolimetaliksi.
Se voi palvella sinua: Ei elektrolyyttejä: ominaisuudet ja esimerkitArseenirakenne
Arseeni on isomorfinen antimonille; Tämä on rakenteellisesti identtisiä, ja ne eroavat vain atomiensa koosta. Jokainen arseenin atomi muodostaa kolme kovalenttisia sidoksia siten, että ne ovat myös peräisin kuusikulmaisista yksiköistä6 "Ryppyinen tai jyrkkä", koska atomien hybridisaatio on SP3.
Sitten yksiköt6 Ne yhdistävät jyrkän arseenikerroksen, jotka ovat vuorovaikutuksessa heikosti keskenään. Molekyylien välisten voimiensa jälkeen, pääasiassa niiden atomimassaan riippuen, harmaa arseeni rhomnenic -kiteet antavat kiinteälle haurasta ja haurasta tekstuurista.
Mahdollisesti arseenielektronien, yksiköiden torjunnasta6 Rinnakkaiskerrosten välinen muodostettu ei määrittele täydellistä oktaedron, vaan vääristynyt:
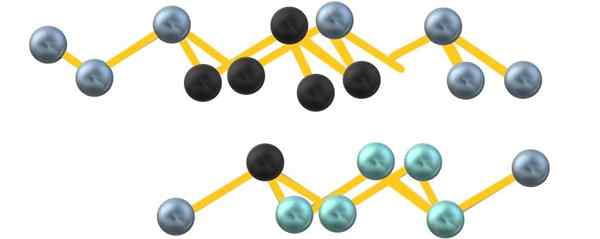 Harmaa arseeni kiteinen rakenne. Lähde: Gabriel Bolívar.
Harmaa arseeni kiteinen rakenne. Lähde: Gabriel Bolívar. Huomaa, että mustat pallot piirtävät vääristyneen tason kahden jyrkän kerroksen väliseen tilaan. Alla olevassa kerroksessa on myös sinertäviä palloja, jotka mustan pallon vieressä muodostavat yksikön6 mainittu osion alussa.
Rakenne näyttää tilattuna, rivit nousevat ja menevät alas, ja siksi se on kiteinen. Sinusta voi kuitenkin tulla amorfinen, puristettujen pallojen kanssa eri tavoin. Kun harmahtavaa arseenia tulee amorfinen, siitä tulee puolijohde.
Keltainen arseeni
Keltainen arseeni, tämän elementin myrkyllisin alotrooppinen, on vain molekyyliyhtiö. Koostuu molekyyleistä4 Yksiköt heikkojen dispersiovoimien avulla, jotka eivät estä niitä haihtumasta.
Musta arseeni
Musta arseeni on amorfinen; Mutta ei kuinka harmahtava alotrope voi olla. Sen rakenne on hiukan samanlainen kuin viimeaikainen6 Heillä on suurempia alueita ja erilaisia häiriökuvioita.
Elektroninen kokoonpano
[AR] 3D104S24P3
On kaikki tason 3 kiertoradat. Muotoile linkkejä käyttämällä 4S- ja 4p -kiertoratoja (samoin kuin 4D) erilaisilla kemiallisilla hybridisaatioilla.
Ominaisuudet
Molekyylipaino
74 922 g/mol
Fyysinen kuvaus
Harmaa arseeni on harmahtavan metallisen näköinen kiinteä ja hauras konsistenssi.
Väri
Kolme allotrooppista muotoa, keltainen (alfa), musta (beeta) ja harmaa (gamma).
Haju
Käymälö
Maku
Mauton
Sulamispiste
1.090 K 35,8 atm (kolminkertainen arseenipiste).
Normaalissa paineessa ei ole fuusiopistettä, koska se sublimoi 887 K.
Tiheys
-Harmaa arseeni: 5,73 g/cm3.
Se voi palvella sinua: Karbonyyliryhmä: Ominaisuudet, ominaisuudet, nimikkeistö, reaktiivisuus-Keltainen arseeni: 1,97 g/cm3.
Vesiliukoisuus
Liukenematon
Atomiradio
139
Atomitilavuus
13,1 cm3/mol
Radiokovalenttinen
120 pm
Erityinen lämpö
0,328 J/g · mol 20 ºC: n lämpötilassa
Haihdutuslämpö
32,4 kJ/mol
Elektronegatiivisuus
2,18 Pauling -asteikolla
Ionisaatioenergia
Ensimmäinen ionisaatioenergia 946,2 kJ/mol
Hapetustilat
-3, +3, +5
Vakaus
Elemental-arseeni on stabiili kuivassa ilmassa, mutta kun se altistetaan kostealle ilmalle, se on peitetty keltaisella pronssikerroksella, josta voi tulla musta arseenioksidin kerros (2JOMPIKUMPI3-A.
Hajoaminen
Kun arseenia lämmitetään hajoamiseen, se emittoi valkoisen savua2JOMPIKUMPI3. Menettely on vaarallinen, koska Arsina voidaan myös vapauttaa, erittäin myrkyllinen kaasu.
Itsenäinen
180 ºC
Kovuus
3.5 MOHS -kovuusasteikolla.
Reaktiivisuus
Kylmä rikkihappo tai konsentroitu suolahappo ei hyökkää siihen. Reagoi typpihapon tai kuuman rikkihapon kanssa, muodostaen arsenihapon ja arseenihapon.
Kun harmaa arseeni haihtutetaan kuumentamalla ja höyryt jäähdytetään nopeasti, muodostuu keltainen arseeni. Tämä palaa harmahtavaan muotoon, kun se altistetaan ultraviolettivalolle.
Sovellukset
Seokset
Pieni määrä arseenia, joka on lisätty lyijyyn, kovettaa sen seoksia tarpeeksi käyttääkseen niitä kaapeleiden limakalvossa ja autoakkujen kehittämisessä.
Arseenin lisääminen messinkille, kuparin ja sinkin seokselle, lisää sen korroosionkestävyyttä. Toisaalta se korjaa tai vähentää sinkin menetystä messingissä, mikä aiheuttaa sen käyttöiän lisääntymistä.
elektroniikka
Puhdistettua arseenia käytetään puolijohdetekniikassa, jossa sitä käytetään yhdessä Gallicin kanssa.
GAA: lla on suora kaistaväli, jota voidaan käyttää diodien, laserin ja LED: n valmistuksessa. Gallium Arseniuron lisäksi on muita arseniuroja, kuten Intian Arseniuro ja alumiini Arseniuro, jotka muodostavat myös II-V-puolijohteet.
Samaan aikaan kadmium Arseniuro on tyypin II-IV: n puolijohde. Arsinaa on käytetty puolijohdekorvausasennossa.
Maatalous ja puun säilyttäminen
Useimmat sovellukset on hylätty niiden suuren myrkyllisyyden ja niiden yhdisteiden vuoksi. Ass2JOMPIKUMPI3 on käytetty torjunta -aineena, kun taas ässä2JOMPIKUMPI5 Se on rikkakasvien torjunta -aineiden ja hyönteismyrkkyjen ainesosa.
Arseenihappo (H3ASO4) ja suoloja, kuten kalsiumia ja lyijyarsenaattia, on käytetty maaperän sterilointiin ja tuholaisten hallintaan. Tämä aiheuttaa ympäristön pilaantumisen riskin arseenilla.
Voi palvella sinua: Nestemäiset elementit: Mitkä ovat ja esimerkkejäLead Arseniatoa käytettiin hyönteismyrkkynä hedelmäpuissa, 1900 -luvun ensimmäiseen puoliskoon asti. Mutta sen myrkyllisyyden vuoksi se korvattiin natriummetyyliarsenaatilla, joka lopetti käytön samasta syystä vuodesta 2013 lähtien.
Lääketieteellinen
1900 -luvulle asti useita niiden yhdisteitä käytettiin lääkkeinä. Esimerkiksi Arsfenamina ja Neolsalvarsan käytettiin syfilis- ja triposomiaasin hoidossa.
Vuonna 2000 AS: n käyttö hyväksyttiin2JOMPIKUMPI3, Erittäin myrkyllinen yhdiste, akuutin promineo-resistentin hoidossa, joka lupaa retino-trans-happahaposta. Äskettäin käytettiin radioaktiivista isotooppia 74Kasvainten sijainnin suhteen.
Isotooppi tuottaa hyviä kuvia, selkeämpiä kuin 124Minä, koska jodi viedään kilpirauhanen ja tuottaa melua signaalissa.
Muut käyttötarkoitukset
Arseenia käytettiin aikaisemmin lisäaineena siipikarjan ja sikojen tuotannossa.
Sitä käytetään katalysaattorina eteenioksidin valmistuksessa. Sitä käytetään myös pyrotekniikassa ja ruskeissa. Arsenioso -oksidia käytetään purkautuneena lasinvalmistuksessa.
Missä se sijaitsee?
Arseenia löytyy pieninä määrinä perustilassa, ja siinä on korkea puhtaus. Sitä esiintyy lukuisissa yhdisteissä, kuten: sulfidit, arsenuros ja sulfarseniuros.
Sitä löytyy myös useista mineraaleista, mukaan lukien: arsenopyriitti (Fesas), Lollingita (ruma2), Enargita (Cu3Perse4), oropimentti (kuten2S3) Ja rejalgar (AS4S4-A.
Kuinka se saadaan?
Arsenopirita kuumennetaan arvoon 650-700 ºC, ilman ilman. Arseeni haihtuu, jättäen jäännöksenä rautasulfidin (FES). Tämän prosessin aikana arseeni sitoutuu happea muotoon4JOMPIKUMPI6, tunnetaan nimellä "valkoinen arseeni".
Ass4JOMPIKUMPI6 Sitä muokataan muodostamaan AS2JOMPIKUMPI3, jonka höyryt kerätään ja tiivistetään tiilikameroihin, puhdistaen arseenin sublimoimalla.
Suurin osa arseenista tuotetaan vähentämällä muodostuneen pölyn hiiltä2JOMPIKUMPI3.
Viitteet
- Stephen R. Marsden. (23. huhtikuuta 2019). Arseenin kemia. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D -d. (3. joulukuuta 2018). Mielenkiintoisia faktoja arseenista. Toipunut: Admingco.com
- Wikipedia. (2019). Arseeni. Haettu: vuonna.Wikipedia.org
- DR. Taikina. (2019). Arseenielementit tosiasiat. Kemikooli. Toipunut: Chemicool.com
- Kuninkaallinen kemian yhdistys. (2019). Arseeni. Palautettu: RSC.Tai
- Enyclopaedia Britannica -toimittajat. (3. toukokuuta 2019). Arseeni. Encyclopædia britannica. Toipunut: Britannica.com
- « Ominaisuudet vähemmistöryhmät, tyypit, esimerkit
- Reynolds -numero mitä se on, miten se lasketaan, harjoitukset »

