Berkelio (BK) rakenne, ominaisuudet, hankkiminen, käyttö

- 625
- 95
- Shawn Stanton II
Hän berlium Se on kemiallinen elementti, jonka symboli on BK. Se kuuluu aktinidiluokkaan, joka on sen kahdeksas jäsen. Atominumerosi on 97. Se on synteettinen metallinen kiinteä aine. Tätä elementtiä ei löydy luonnollisesti maankuoren yli. Sitä on pieninä määrinä käytetyissä ydinpolttoaineissa ja siinä on hopeakiitos.
Ympäristössä on myös dispergoituja pieniä määriä ydinaseiden testien vuoksi, koska atomienergialaitosten, kuten Tšernobylin, vakavien onnettomuuksien aiheuttamat vakavat onnettomuudet ja ydinenergialaitosten jätteiden vapautumisen vuoksi.
 Berkelio -elementin symboli, numero ja atomimassa. Lähde: ME/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/2.5). Lähde: Wikimedia Commons.
Berkelio -elementin symboli, numero ja atomimassa. Lähde: ME/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/2.5). Lähde: Wikimedia Commons. Berkelion käytännön hyödyllisyyttä ei ole löydetty, koska sitä esiintyy hyvin pieninä määrinä ja tosiasia, että kaikki sen isotoopit (BK -atomit, joilla on erilainen neutronien lukumäärä ytimessä) ovat radioaktiivisia. Sen pääsovellus on ollut tieteellisissä tutkimuksissa.
Vaikka niiden isotoopit ovat keinotekoisesti tuotettu erityisissä laboratorioissa ja asiantuntijahenkilöstö käsittelee niitä, vaaran säteilyn aiheuttamat vahingot on aina otettava huomioon.
[TOC]
Nimikkeistö
- Berkelio, BK -symboli.
- Berkelio-243, BK-243 tai 243BK: Berkelio -isotooppi atomismassalla 243.
Löytö
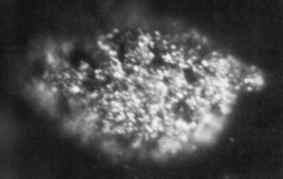 1.7 Mikrofotografia mikrogrammit kiinteästä metallisesta Berkeliosta, joka on saatu vuonna 1969. Oak Ridgen kansallinen laboratorio, Yhdysvaltain energia- / julkinen laitos. Lähde: Wikimedia Commons.
1.7 Mikrofotografia mikrogrammit kiinteästä metallisesta Berkeliosta, joka on saatu vuonna 1969. Oak Ridgen kansallinen laboratorio, Yhdysvaltain energia- / julkinen laitos. Lähde: Wikimedia Commons. Sen tuotti ensimmäisen kerran vuonna 1949 tutkijat Glen Seaborg, Stanley G. Thompson ja Al Ghiorso Berkeleyn yliopistossa Kaliforniassa, kun he pommittivat Americio-241: tä korkeaenergialla alfa-hiukkasilla syklotronilla (hiukkaskiihdytin).
Välittömästi säteilytyksen jälkeen materiaali liuennettiin oikein ja kuljettiin ioninvaihtohartsipylvään läpi käyttämällä ammoniumsitraattiliuosta eluentina.
Tällä tavoin he saivat elementin numeron 97 isotooppia 243 atomimassalla, joka säteilee alfahiukkasia ja jonka puoliikä on 4,5 tuntia.
Elementin nimi
Ensinnäkin useat tutkijat ehdottivat, että elementti ottaa yhden sen löytäjän, Glen Seaborgin, nimen, koska hänellä oli ansio siitä, että hän oli onnistunut syntetisoimaan 10 elementtiä useiden vuosien työn aikana.
Voi palvella sinua: dekantterilasterinPure- ja Applied Chemistry tai IUPAC: n virallinen organisaatio kansainvälinen liitto (lyhenne englanniksi Kansainvälinen puhtaan ja sovelletun kemian liitto) päätti antaa nimen "Berkelio" saatuaan yliopistossa ja Berkeleyn kaupungissa (Kalifornia).
 Berkeleyn yliopiston alueen esiintyminen, Kalifornia. Kirjoittaja: Sarangib. Lähde: Pixabay.
Berkeleyn yliopiston alueen esiintyminen, Kalifornia. Kirjoittaja: Sarangib. Lähde: Pixabay. Nimi Berkeley on peräisin Angloirlandés -filosofista George Barkeley, nimi, jonka ääntäminen muuttui sitten Yhdysvalloissa, kun kaupunki ja yliopisto perustettiin vuonna 1869.
Se oli satunnaisesti vuosi, jolloin Dmitri Mendeléyev julkaisi ensimmäisen jaksollisen taulukonsa ja alkoi ennustaa uusien elementtien, kuten Berkelion, olemassaoloa.
Elektroninen rakenne
Sen sähköinen kokoonpano on:
1s2; 2s2 2p6; 3s2 3p6 3d -d10; 4s2 4p6 4d -d10 4F14; 5s2 5p6 5d -d10; 6s2 6p6; 5F9 7s2,
tai kompakti:
[RN] 5F9 7s2.
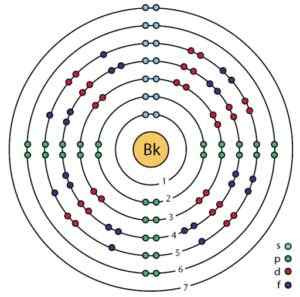 Berkelio -elektroninen rakenne. Orbitaalit ja elektronit voidaan nähdä. Ahatsardi.ScienceWriter/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
Berkelio -elektroninen rakenne. Orbitaalit ja elektronit voidaan nähdä. Ahatsardi.ScienceWriter/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Saada
Metallin ensimmäinen näyte valmistettiin vuonna 1969 fluoridin pelkistysreaktiolla (BKF3) Litiummetallilla (Li) lämpötilassa 1300 K.
Ohut metallilevyjen valmistamiseksi BKO -oksidi vähenee2 Torio (TH) tai Metallic Lantano.
Berkelion fysikaaliset ominaisuudet
Fyysinen tila
Sileä metallinen kiinteä aine.
Berkelio -metallilla on kaksi kiteistä muotoa: alfa (kaksinkertainen kompakti kuusikulmainen) ja beeta (kuutio keskittynyt kasvoihin).
Atomimassa
247
Sulamispiste
1050 ºC (alfa -muoto)
986 ° C (beeta -muoto)
Kiehumispiste
2627 ºC
Tiheys
14,78 g/cm3 (Alfa -muoto)
13,25 g/cm3 (Beeta -muoto)
Paramagnetismi
Joidenkin lähteiden mukaan tietyt Berkelioyhdisteet osoittavat paramagneettisia ominaisuuksia, mikä tarkoittaa, että ne houkuttelevat magneettikenttiä.
Tämä ominaisuus on paramagneettinen tyyppinen, koska magneettisen toiminnan suspendinnissa materiaali ei ylläpitää pelkästään tällaisia ominaisuuksia.
Kemialliset ominaisuudet
Korkeissa lämpötiloissa metallinen Berkelio hapettuu nopeasti ilmassa tai hapessa, muodostaen sen oksidit. Se on helposti liukoinen mineraalihapoihin, vapauttaen vetykaasua H2 ja muodostaen BK -ioneja3+.
Voi palvella sinua: alumiinihydridi (ALH3): rakenne, ominaisuudet, käyttötarkoituksetHapetustilat
Tämän elementin alkuperäiset tutkimukset rajoittuivat ioninvaihto- ja selvityskokeisiin, joiden kanssa havaittiin, että hapetustila +3 on stabiili ja +4 on saatavilla vesiliuoksessa, koska BK3+ Bromato -ioni voi hapettaa sen (veli4-) Antaa bk4+.
BK -stabilointi4+
Vuonna 2017 BK: n stabiloinnista ilmoitettiin4+ liuoksessa käyttämällä yhdistettä, jonka muodostaa hydroksipiridinoniryhmät yhdistyneinä polyamiinirakenteeseen (nimeltään Ligand 3,4,3-LI (1,2-hop)).
Tällä yhdisteellä on kahdeksan paikkaa, joissa ioni liittyy, jotka vastaavat ryhmien c = O ja n-OH: n happiatomeja, jättäen BK: n4+ tiukasti sidoksissa ligandiin, pysyen vakaana.
Kiinteät yhdisteet
Bk4+ voi todistaa CERIO: n kanssa (CE4+) tai zirkonium (ZR4+) fosfaatissa tai yodatossa. Se voidaan myös erottaa bis-heksaaniliuoksissa (2-etyyliheksil) vetyfosfaatissa tai muussa vastaavassa aineetissa.
Ensimmäinen Berkelio -yhdiste, joka tapahtui näkyvinä määrinä, oli kloridi (BKCL3), josta saatiin 0,000000003 grammaa vuonna 1962. Siitä lähtien useat Berkelioyhdisteet ovat kyenneet valmistautumaan ja opiskelemaan.
Ne voidaan mainita esimerkiksi fosfaatti (BKPO4), oksikloridi (bkocl), fluoridit (BKF3 ja bkf4), Dioksidi (BKO2), trioksidi (BK2JOMPIKUMPI3), Yodatos (BK (IO3-A3 ja bk (io3-A4), Klorohydraatti [bkcl2(H2JOMPIKUMPI)6] Cl, oksalaatti, organomethiset yhdisteet ja koordinaatioyhdisteet.
Uusi hapetustila +5
Vuonna 2018 ryhmä tutkijoita useista maista onnistui tuottamaan nitraattikompleksin Pentavalentin Berkelion kanssa (BK5+) kenen kaava on BKO2(EI3-A2-, Poistamalla kaksi Molekyyliä2 BK -ionista (ei3-A4-, (BK3+-A.
Laskennalliset energialaskelmat vahvistivat, että hapetustila +5 on se, jolla on suurin stabiilisuus tässä Berkenilo -nitraattikompleksissa, siksi todennäköisin.
Isotoopit
Berkeliosta 14 isotooppia, joissa on atomimassat, on syntetisoitu välillä 238 - 251. Kaikki ovat radioaktiivisia.
Se voi palvella sinua: Benchilo: Bentsyylihydrogeenit, karbokaatiot, bentsyyliradikaalitVakain on Berkelio-247, jonka puoliintumisaika on 1380 vuotta. Jokainen tämän isotooppin atomi hajoamisen yhteydessä emittoi alfahiukkaset ja muodostaa Amerikan 243 atomin.
BK-249: n puoliintumisaika on 330 päivää, se kärsii beeta-rappeutumisesta ja siitä tulee Californio-249.
Sovellukset
Koska he ovat pystyneet saamaan vain hyvin pieniä määriä tätä elementtiä, sitä käytetään vain tieteellisessä perustutkimuksessa.
Raskaampien elementtien saamisessa
Isotoope BK-249: llä on suhteellisen pitkä puoliintumisaika ja se on mahdollista.
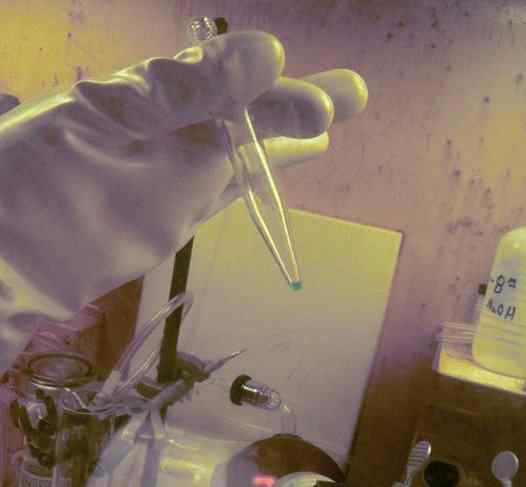 BK -mikrokonantti liuenneen koeputkeen. Sen saamiseen käytettiin 250 päivää. Tämän elementin radioaktiivisuuden suojaus hansikkaa voidaan havaita. Ornl, energia- / julkinen laitos. Lähde: Wikimedia Commons.
BK -mikrokonantti liuenneen koeputkeen. Sen saamiseen käytettiin 250 päivää. Tämän elementin radioaktiivisuuden suojaus hansikkaa voidaan havaita. Ornl, energia- / julkinen laitos. Lähde: Wikimedia Commons. Fysikaalisissa tutkimuksissa
BK: n kanssa tehty tutkimus mahdollistaa tarkempia ekstrapolointeja muiden näyttelijasarjoissa seuraavien elementtien ominaisuuksista ja käyttäytymisestä, koska raskaimpia elementtejä on vaikeampi hankkia, niillä on hyvin lyhyt keskimääräinen elämä ja ne ovat paljon radioaktiivisempia.
Riskejä
Berkelio on radioaktiivinen elementti. Radioaktiivisuuden vapautuminen ympäristössä voi saavuttaa kaikki eläinlajit ja kasvilajit aiheuttaen heille vaurioita. Heikkeneminen voi kertyä peräkkäisissä sukupolvissa.
 Ydinen energiakasvit ovat radioaktiivisia ja siksi erittäin vaarallisia. Kirjoittaja: AR130405. Lähde: Pixabay.
Ydinen energiakasvit ovat radioaktiivisia ja siksi erittäin vaarallisia. Kirjoittaja: AR130405. Lähde: Pixabay. Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Berlium - BK (elementti). PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Valkoinen, f.D -d. et al. (2019). Berliumin ja Kalifornian nykyaikainen kemia. Kemia 2019 6. elokuuta; 25 (44): 10251-10261. Palautettu PubMedistä.NCBI.Nlm.NIH.Hallitus.
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Kelley, m.P. et al. (2018). Bond Covaleky ja Aktinidi-INS: n hapettumistila, joka on kompleksoitu terapeuttisella kelatointiaineella 3,4,3-LI (1,2-hopo). Inorg. Kemia. 2018 7. toukokuuta; 57 (9): 5352-5363. Palautettu PubMedistä.NCBI.Nlm.NIH.Hallitus.
- Kovács, a. et al. (2018). Pentavalent curium, berlium ja californium nitraattikompleksissa: Aktinidikemian ja hapettumistilojen laajentaminen. Kemia. 2018 6. elokuuta; 57 (15): 9453-9467. Palautettu PubMedistä.NCBI.Nlm.NIH.Hallitus.
- Orlova, a.Yllyttää. (2007). Vedetöntä kolmiulotteisten aktinidi-ortofosferien kemia ja rakennekemia. Epäorgaanisten aktinidiyhdisteiden rakenteellisessa kemiassa. ScienEdirect.com.
- Choppin, G. et al. (2013). Aktinidi- ja transaktinidielementit. Radiokemiassa ja ydinkemiassa (neljäs painos). ScienEdirect.com.
- Peterson, J.R -. ja Hobart, D.JA. (1984). Berliumin kemia. Advances epäorgaaninen kemia, osa 28, 1984, sivut 29-72. ScienEdirect.com.
- Kuninkaallinen kemian yhdistys. (2020). Berlium. RSC toipunut.org.
- « Esihistorian musiikin historia
- Didaktisen suunnittelun ominaisuudet, elementit, tyypit, esimerkki »

