Heikko happo
- 4906
- 628
- Mr. Clifford Kshlerin
 Heikot happoesimerkit
Heikot happoesimerkit Mikä on heikko happo?
Heikko happo on yksi, joka vesiliuoksessa on vähän kykyä dissosioitua vedyssä (H+) ja vastaavassa konjugoidussa pohjassa. Toisin kuin vahvat hapot, joiden dissosiaatio on täydellinen (100%) ja käytännössä peruuttamattomat, heikot hapot ovat tuskin dissosioituneita ja palautuvia.
Siksi heikko happo tuottaa vähemmän hioa h+ Vedessä mitä odotetaan. Edustavimmista heikkoista hapoista, joita meillä on etikkahappoa, etikan pääkomponentti, joka on suunnilleen 0: ssa.5 % normaaleissa olosuhteissa.
Tämä tarkoittaa, että suurin osa etikkahappoliuoksesta vedessä, kuten 5%keittämisetikka3Cooh); Vaikka konjugaattipohjana löytyy pieni annos (valitse3Kujertaa-), H -ionien mukana+, tai oikein, H -ionit3JOMPIKUMPI+.
Sitten, koska vetymäärä, jonka heikon happo vapautuu vesiliuoksessa, on pieni, niiden tuottama pH on suurempi (emäksinen) kuin vahvan hapon tuottama. Esimerkiksi etikan pH on 2.5, appelsiinimehu pH 3.3. 4.2 ja 2 sitruunamehua 2.
Nämä pH, vaikka ne ovat happamia, ovat korkeammat kuin pH, joka tuottaa vahvan hapon liuoksen (HCl, H2Sw4, jne.) että ne voivat saavuttaa arvon 1 tai vähemmän (negatiiviset pH -arvot).
Heikkojen happojen ominaisuudet
ratkaisujen pH
Heikkojen happojen pH on yleensä välillä 2.0 ja alle 7.0, joten he kääntävät pannasolipaperin värin punaisena. Nämä pH -arvot ovat paljon suurempia kuin vahvojen happojen tuottamat pH -arvot, vaikkakin on poikkeuksia.
Esimerkiksi 1 mM: n suolahappoliuoksen (vahva happo) on pH 3.0, kun taas 1 mM: n fluoriahappo liuoksen ("heikko" happo), pH on 3.2, joka on lähellä vahvaa happoa.
Osittainen ionisaatio
Liuoksen heikot hapot ionisoidaan vähän tai osittain vedessä, dissosiaatiossa happo- ja vety -ionin konjugoidussa emäksessa. Sitten vesipitoisessa liuoksessa oleva heikko happo on enimmäkseen dissosioitunut, pienellä dissosioituneella osuudella.
Voi palvella sinua: kemiallisten yhtälöiden tasapainottaminenKun heikon hapon vapauttaman vedyn määrä vedessä on alhainen, tämän hapon tuottama pH on korkeampi kuin veteen liuenneen voimakkaan hapon tuottama, koska ne yleensä ionisoidaan 100 %: lla.
Palautuva ionisaatio
Heikon hapon ionisaatio kaavioidaan yleensä seuraavasti:
On ⇌ a- + H3JOMPIKUMPI-
Missä on heikko happo,- sen konjugoitu emäs ja h3JOMPIKUMPI+ Hydroniumkation, joka on tapa h+ Se on olemassa tai ilmenee vedessä. H: n pitoisuus (tai aktiivisuus)3JOMPIKUMPI+ Sitä käytetään H: n sijasta+ Liuoksen liuoksen määrittämiseksi.
Ionisaatioaste
Jotkut hapot ovat heikompia kuin toiset, mikä on sama sanottavaa, että ne ovat vähemmän ionisoituja. Siksi ionisaation aste antaa meille mahdollisuuden vilkaista kuinka hapan happo on tietyissä olosuhteissa.
Ionisaation asteen ilmaisemiseksi otettiin käyttöön useita parametreja, kuten ionisaatio tai happamuusvakio (KA) ja PKA: tapa ilmaista KA yksinkertaisessa numerossa, joka jättää määrän käyttöä, joka ilmaistaan negatiivisissa voimissa kymmenen (10 ), kuten se on KA: ssa.
KA- ja PKA -vakioita käytetään pääasiassa heikkoihin happoihin.
Ka = [a-] [H+] / [Ha]
Kaavassa olevat kiinnikkeet edustavat pitoisuuksia.
pka = - log ka
Heikon hapon PKA -arvo vaihtelee yleensä välillä 2 - 12. Mutta on poikkeuksia. Esimerkiksi: ja ja odaginen happo (HIO3) PKA on 0.77, jota pidetään suhteellisen pienenä arvona, mutta ilman negatiivista, heikkolle hapolle tiukassa merkityksessä.
Konjugaatti perusteellisuus
Heikoilla hapolla on vahva sidos happovetyatomin kanssa (HΔ+-XΔ-), joten heillä on alhainen vedyn dissosiaatio. Tämä johtaa siihen, että heikon hapon konjugoidussa emäksessä on suuri aviditeetti vetyllä, koska se on vahva konjugoitu emäs.
Voi palvella sinua: kolloidiToisin sanoen heikko hapon konjugoitu emäs on erittäin epävakaa, koska se hyväksyy h+ palasi hyvin helposti. Mitä epävakaampi tämä konjugoitu emäs, sitä heikompi happo on kyseenalainen.
Alhainen ionin johtavuus
Pieni ionisoitu, heikot hapot ovat huonoja sähköjohtimia, toisin kuin vahvat hapot, jotka ovat hyviä sähköjohtimia.
Läsnäolo luonnossa
Esimerkiksi heikkoja hapoja on levinnyt luonteeltaan, ne ovat sitrushedelmissä (sitruuna, greippi, appelsiini jne.).
Niitä esiintyy myös lukuisissa prosesseissa, joita esiintyy kaikissa elävissä olennoissa. Jotkut näistä biologisista heikkoista hapoista ovat pyruvic, maito, sitruunat, fumarinen, suppin, glutaminen jne., ja jopa hapetettu hemoglobiini vapauttaa vetygenioita, joten se käyttäytyy kuin heikko happo.
Sitten voidaan päätellä, että ihminen elää pysyvässä kosketuksessa heikkojen happojen kanssa.
Kuinka laskea heikon hapon pH?
Heikon hapon pH voidaan laskea käyttämällä happamisvakiota (KA) tai käyttämällä Henderson-Haselbalch-yhtälöä. Ensimmäisessä esimerkissä KA käytetään.
Happamuusvakiona
Laske liuoksen 0 pH.5 m bentsoehapoa (C6H5Cooh), jolla on ionisaatiovakio (KA) = 1.8 x 10-5
C6H5Cooh ⇌ c6H5Kujertaa- + H+ (1)
Jos dissosiaatioiden happoa kutsutaan x, niin 0.5 m-x on heikon hapon pitoisuus, joka ei ole dissosioitunut tasapainossa, bentsoehapon ja vety-ionipitoisuuden konjugaattipohjan konsentraatio.
Yhtälö (1) voidaan esittää seuraavasti:
0 -.5 m-x ⇌ x +x
Heikot hapot ionisoidaan erittäin alhaisessa osassa, joten bentsoehapon pitoisuus tasapainossa (0.5 m-x), voidaan olettaa 0.5 m, koska x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Siksi [h+] on yhtä suuri kuin 3 x 10-3 M. Ratkaisemme sitten laskemalla pH:
Se voi palvella sinua: Mohr -menetelmä: Perusteet, reaktiot, menettely, käyttöph = - log [h+-
= - loki [3 x 10-3-
pH = 2.52
Huomaa, että pH on suhteellisen hapan, koska se sijaitsee alle 3 tai 4.
Henderson-Haselbalch-yhtälön kanssa
Henderson-Haselbalch-yhtälöä käytetään puskuriliuoksen pH: n laskemiseen:
pH = pka + log [konjugoitu emäs] / [happo]
Esimerkki:
Natriumhydroksidia (NaOH) lisätään etikkahappoliuokseen, mikä tuottaa etikkahapon lopullisen konsentraation (CH CH3Cooh) 1.11 x 10-2 mol/l ja konjugaattipohjapitoisuus (valitse3Kujertaa-) 0.44 x 10-2 mol/l. Jos etikkahappo PKA on 4.75 Laske liuoksen pH.
pH = 4.75 +loki [a-] / [Ha]
pH = 4.75 +loki (0.44 x 10-2 / 1.11 x 10-2-A
= 4.75+ loki 0.396
= 4.348
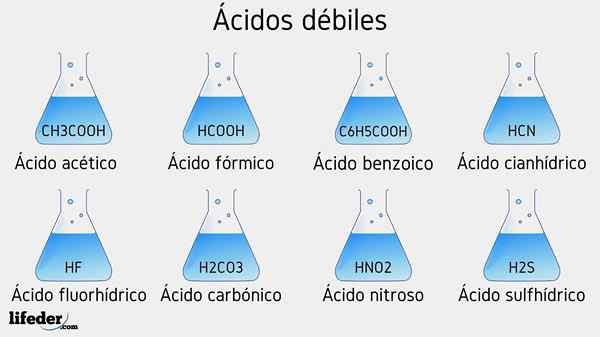
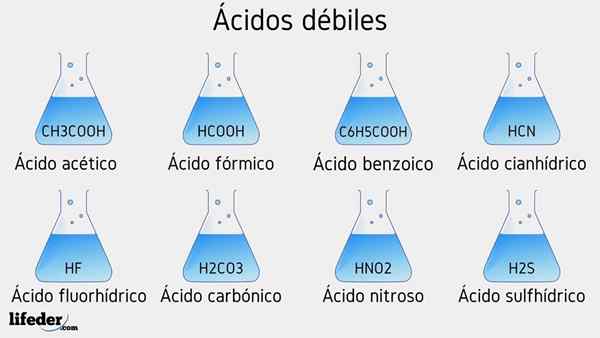
Heikot happoesimerkit
Useita heikkoja happoja, joihin liittyy niiden PKA -arvot, luetellaan alla:
- CH3COOH (etikkahappo), PKA 4.75
- HCOOH (muurahaishappo), PKA 3.74
- C6H5COOH (bentsoehappo), PKA 5.59
- CH2Clcoh (kloorihappo), PKA 2.85
- HCN (syanhydrihappo), PKA 9.31
- HF.17
- C2H5COOH (propionihappo), PKA 4.89
- Hno2 (Typpihappo), pka 3.35
- H2S (sulfidihappo), pka1 6.0 ja pka2 12.92
- CCL3COOH (trikloorietikkahappo), PKA 0.52
- H2Yhteistyö3 (hiilihappo), PKA1 6.37 ja pka2 10.22
- H3Poikki4 (fosforihappo), PKA1 2.12, pka2 4.21 ja pka3 yksitoista.0 -
- C6H5Sw3H (bentsikonihappo), PKA 0.70
- Hio3 (Yodiumhappo), pka 0.77
- Hclo2 (Kloorihappo), PKA 2.0 -
- CH3CH2(OH) COOH (maitohappo), pka 3.08
Heikot hapot, joilla on terapeuttinen käyttö
- Salisyylihappo, pka 3.00
- Asetyylisalisyylihappo, PKA 3.49
- Furosemidi, pka 3.90
- Ibuprofeeni, pka 4.40
- Levodopa, pka 2.30
- Fenobarbital, PKA 7.40
- Warfarina, pka 5.0 -
- Teofilina, pka 8.80
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Morris, J. G. (1974). Biologien fysikakemia. (2. painos.-A. Käännyin.
- Helmestine, Anne Marie, PH.D -d. (29. elokuuta 2020). Heikko hapon määritelmä ja esimerkki kemiassa. Toipunut: Admingco.com
- Ophardt c., & McCarthy L. (15. elokuuta 2020). Happo- ja emäslujuus. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Clark Jim. (2013). Vahva ja heikko happo. Talteenotettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- Luumen oppiminen. (S.F.-A. Kemia muille kuin haittareille: Heikkojen happo- ja emäsliuosten pH: n laskeminen. Toipunut: kurssit.Lumenarning.com

