Litiumkarbonaatti (LI2CO3) rakenne, ominaisuudet, käytöt

- 4979
- 1192
- Arthur Terry II
Hän litiumkarbonaatti Se on epäorgaaninen+ ja karbonaatti -anionin Co32-. Sen kemiallinen kaava on Li2Yhteistyö3. Li2Yhteistyö3 Se on valkoinen kiteinen kiinteä aine, joka voidaan saada reaktiolla litiumhydroksidin ja hiilidioksidin välillä.
Litiumkarbonaatilla on erittäin korkea fuusiopiste, joten sitä käytetään lasin, keramiikan ja posliinin valmistuksessa. Sillä on hyvin monipuolisia käyttötarkoituksia, kuten ladattavia litiumparistoja, muiden litiumyhdisteiden, hitsauselektrodien valmistuksessa sekä maalauksissa ja lakoissa.
 Litiumkarbonaatti Li2Yhteistyö3 kiinteä. Kuva, joka on ottanut W: Käyttäjä: Walkerma kesäkuussa 2005. Lähde: Wikimedia Commons.
Litiumkarbonaatti Li2Yhteistyö3 kiinteä. Kuva, joka on ottanut W: Käyttäjä: Walkerma kesäkuussa 2005. Lähde: Wikimedia Commons. LI käytetään myös2Yhteistyö3 Sementti -seoksissa nopean asetuksen ja alumiinin tuotannon saavuttamiseksi.
Yksi sen tärkeimmistä käytöistä on joidenkin mielisairauksien, kuten masennuksen ja liiallisen aggressiivisen käyttäytymisen hoidossa, muun muassa muun muassa.
Lääketieteellisten asiantuntijoiden on kuitenkin valvottava sen käyttöä lääkkeenä, koska ihmiset hoidetaan LI: llä2Yhteistyö3 Ne voivat kärsiä terveydelle haitallisia vaikutuksia, kuten kilpirauhasen vajaatoiminta (kilpirauhanen vähentynyt toiminta).
[TOC]
Rakenne
Litiumkarbonaatti koostuu kahdesta litiumista+ ja karbonaatti -anionin Co32-.
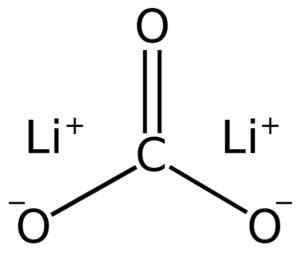 Lii -litiumkarbonaattirakenne2Yhteistyö3. Adrian kädet [julkinen alue]. Lähde: Wikimedia Commons.
Lii -litiumkarbonaattirakenne2Yhteistyö3. Adrian kädet [julkinen alue]. Lähde: Wikimedia Commons. Elektroninen litiumkokoonpano hapetustilassa +1 on 1s2 2s0 -, No, hän on menettänyt viimeisen kerroksen elektronin, siten vakaampi. Karbonaatti ion co32- Sillä on tasainen rakenne.
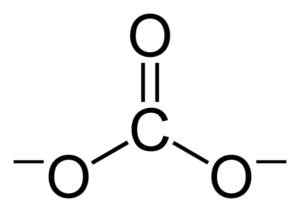 Hiili -ionin CO: n litteä rakenne32-. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
Hiili -ionin CO: n litteä rakenne32-. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Negatiiviset kuormat jakautuvat tasaisesti hiili -ionin Co: n kolmen happiatomin kesken32-.
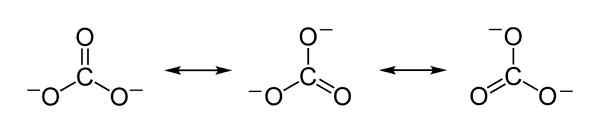 Karbonaatti -ionin Co: n teoreettiset resonanssirakenteet32- jotka selittävät negatiivisten kuormitusten oikeudenmukaisen jakautumisen kolmen happiatomin välillä. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
Karbonaatti -ionin Co: n teoreettiset resonanssirakenteet32- jotka selittävät negatiivisten kuormitusten oikeudenmukaisen jakautumisen kolmen happiatomin välillä. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Nimikkeistö
-Litiumkarbonaatti
-Karbonaatti
Fyysiset ominaisuudet
Fyysinen tila
Monokliinisen rakenteen kiteinen valkoinen kiinteä aine
Molekyylipaino
73,9 g/mol
Sulamispiste
723 ºC
Hajoaminen
Se hajoaa nopeudella 1300 ºC.
Tiheys
2,11 g/cm3
Liukoisuus
Pikku liukeneminen veteen: 1,31 % painon mukaan 20 ºC: n lämpötilassa. Sen veden liukoisuus laskee lämpötilan noustessa. Se liukenee laimennettuihin happoihin. Se on liukenematon alkoholiin ja asetoniin.
Voi palvella sinua: bariumoksidi (BAO): rakenne, ominaisuudet, käytöt, riskitPHE
Vesiliuokset ovat emäksisiä, niiden pH on yli 7.
Kemialliset ominaisuudet
Li2Yhteistyö3 Se hydrolysoituu vesiliuoksessa, joka tuottaa emäksistä liuosta. Pieni osuus yhdisteestä, joka liukenee veteen, poistuu karbonaatti -anionista32-.
Karbonaatti anion co32- Vesipitoisessa liuoksessa on Proton HCO -bikarbonaatti -anionin muodostamiseksi3-, Kuten seuraavassa reaktiossa voidaan nähdä:
Yhteistyö32- + H2O → HCO3- + vai niin-
OH -ionien läsnäolo- Se tekee ratkaisusta perustiedot.
Biologiset ominaisuudet
Eläin- ja ihmisen kudoksissa on normaalisti litium -ionin jälkiä, mutta tähän ionin luonnollinen fysiologinen rooli hetkeen asti ei tunneta.
Ihmisen organismissa Li2Yhteistyö3 Lääkityksenä nielty, vaikuttaa moniin neuronien ja muiden solujen signalointimekanismeihin. Tämä johtuu kationien, kuten natriumin ja kaliumin, korvaamisesta.
Litiumionin sisällyttäminen solukalvon rakenteeseen voi muuttaa vastetta hormoneihin ja solukytkentäen energiaprosessien kanssa.
Tällä tavalla litium muuttaa useita soluprosesseja, mukaan lukien aineenvaihdunta.
Muuttamalla tapaa, jolla solut toimivat2Yhteistyö3 Voit toimia aivojen neuronien viestintämekanismeissa.
Saada
Li2Yhteistyö3 Se voidaan saada litiumhydroksidireaktiolla hiilidioksidin kanssa2, Kuten alla:
2 LioH + Co2 → Li2Yhteistyö3 + H2JOMPIKUMPI
Kaupallisesti esiintyy litiumia sisältävistä mineraaleista, kuten spotumi ja lepidoliitti. Näitä mineraaleja käsitellään korkeissa lämpötiloissa tietyillä sulfaattisuoloilla tai alkalisilla yhdisteillä litiumsuolojen saamiseksi.
Saadut litiumsuolat puhdistetaan vesi- tai happoliuoksilla ja sitten ne käsitellään karbonaateilla LI: n muodostamiseksi2Yhteistyö3.
Kuitenkin Li2Yhteistyö3 Tällä tavalla saavutettu on saastunut sulfaateilla tai kalsiumklorideilla, magnesiumilla, raudalla, natriumilla, kaliumilla jne. Joten vaadita seuraavaa puhdistusta.
Sovellukset
Mielisairauksien hoidossa
Sitä käytetään masennuslääkkeenä, antimaniakin aineena, aggressiivisen impulsiivisen käyttäytymisen ja kaksisuuntaisen häiriöiden hoidossa (ihmiset, jotka muuttavat huumoriaan yhtäkkiä ilman mitään syytä, tulevat väkivaltaisiksi).
Voi palvella sinua: 20 esimerkkiä kemiallisesta sublimaatiosta ja ominaisuuksista Joitakin aggressiivisia impulsiivisia häiriöitä voidaan hoitaa Li2Yhteistyö3. Kirjoittaja: Prawny. Lähde: Pixabay.
Joitakin aggressiivisia impulsiivisia häiriöitä voidaan hoitaa Li2Yhteistyö3. Kirjoittaja: Prawny. Lähde: Pixabay. Lääkärit ovat havainneet, että niiden antaminen johtaa masennuksen ja maanisten jaksojen voimakkuuden ja tiheyden vähentymiseen.
Sitä käytetään yksin, toisin sanoen ilman lisättyä yhdiste. Se myös lisää muiden lääkkeiden masennuslääkevaikutusta.
Vaikka sitä on käytetty lasten hoitamiseen, joilla on ilmeisiä oireita bipolaarisesta häiriöstä ja hyperaktiivisuudesta neuroottisten tai aggressiivisten komponenttien kanssa, se ei ole ollut tehokasta kaikissa tapauksissa.
Muiden sairauksien oireiden hoidossa
Sitä käytetään vähentämään voimakkaita päänsärkyjä, toistuvia ja kroonisia.
Sitä käytetään vähentämään infektioiden esiintyvyyttä potilailla, joilla on kemoterapiaa aiheuttama neutropenia tai muut syyt. Neutropenia on neutrofiilien, tyyppinen valkosolut, jotka auttavat torjumaan kehon infektioita.
Sitä on käytetty kilpirauhasen entsyymin estäjänä kilpirauhasen hoidossa, mutta se ei ole edullinen hoito sen haittavaikutusten vuoksi.
Hallintomuoto
Sitä käytetään Li -tablettien tai kapselien muodossa2Yhteistyö3. Myös hitaasti vapauttavat tablettit litiumsitraatilla. Li on suositeltava2Yhteistyö3 Koska se ei ärsytä kurkkua nielemällä sitä, kuten se tapahtuu muiden litiumsuolojen kanssa.
 Kirjoittaja: Pete Lyforth. Lähde: Pixabay.
Kirjoittaja: Pete Lyforth. Lähde: Pixabay. Haittavaikutukset
Li2Yhteistyö3 Sillä voi olla haitallista vaikutusta kilpirauhasen ja munuaisten suhteen, joten näiden elinten toimintaa on tarkkailtava ennen tämän yhdisteen käsittelyä ja sen aikana.
Li2Yhteistyö3 Se voi olla myrkyllistä pitoisuuksissa, jotka ovat hyvin lähellä lääketieteellisissä hoidoissa käytettyjä pitoisuuksia, joten niiden veren seerumin arvojen jatkuva katsaus vaaditaan.
Li Myrkytysoireet2Yhteistyö3 Ne ovat vapinaa, lihasten kouristuksia, lihasheikkoutta, ripulia, oksentelua, uneliaisuutta tai ataksiaa (lihaksen koordinaation heikkeneminen).
Lirapian alussa2Yhteistyö3 Myös oireita, kuten vapina, päänsärky ja pahoinvointi. Mutta nämä yleensä katoavat jatkamalla lääkitystä.
Voi palvella sinua: HolmioSuurimmalla osalla hoidetuista ihmisistä voi myös kehittyä leukosytoosia (valkosolujen lukumäärän kasvu), mutta tämä on palautuvaa.
Ihmiset, joita lääkitetään Li2Yhteistyö3 Niiden ei tulisi käsitellä ajoneuvoja tai käyttökoneita, koska se vähentää fyysistä koordinaatiota ja kykyä suorittaa toimintoja, jotka on oltava valppaana.
Tapauksia, joissa sitä ei pidä antaa
Sitä ei tule käyttää alle 12 -vuotiailla lapsilla, koska se voi häiritä luiden muodostumista ja niiden tiheyttä, koska se muuttaa kilpirauhashormonin pitoisuuksia. Sillä on taipumus myös käyttää kalsiumin paikkaa luissa.
Heitä ei pidä kohdella Li2Yhteistyö3 Ihmiset, joilla on sydän- ja verisuonisairaus, munuaiset tai kilpirauhaset. Eikä vakavasti kuivuneilla potilailla.
Raskaana olevia naisia ei pidä antaa etenkin raskauden ensimmäisen kolmanneksen aikana. Litium ylittää istukan ja voi saavuttaa sikiön helposti mahdollisilla teratogeenisillä vaikutuksilla, ts. Se voi tuottaa poikkeavuuksia tai epämuodostumia, jotka ovat panimossa.
Vanhukset, jotka tarvitsevat hoitoa Li2Yhteistyö3 Niitä tulisi hoitaa suurella huolellisesti ja annoksilla kuin nuoret aikuiset, koska he voivat kehittää kilpirauhasen vajaatoimintatauti.
Muut käyttötarkoitukset
Li2Yhteistyö3 Korkeaa puhtautta käytetään laajasti litiumin ladattavien akkujen valmistuksessa.
Sitä käytetään sulaan karbonaattipolttokennoissa.
Sitä käytetään sähköisen posliinin valmistuksessa, joka on eräänlainen sähköeristävä posliini. Sitä käytetään myös lasituksen tuotannossa keramiikassa.
 Li2Yhteistyö3 Sitä käytetään sähköisen posliinin valmistukseen, jota käytetään sähköeristimenä, esimerkiksi sähkötehoissa. FIR0002 Flagstoffotos [AT] Gmail.com Canon 20d + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.GNU.Org/lisenssit/vanhojen lisenssit/FDL-1.2.HTML)]. Lähde: Wikimedia Commons.
Li2Yhteistyö3 Sitä käytetään sähköisen posliinin valmistukseen, jota käytetään sähköeristimenä, esimerkiksi sähkötehoissa. FIR0002 Flagstoffotos [AT] Gmail.com Canon 20d + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.GNU.Org/lisenssit/vanhojen lisenssit/FDL-1.2.HTML)]. Lähde: Wikimedia Commons. Se mahdollistaa keramiikan valmistamisen alhaisella laajennuskertoimella, ts. Se laajenee hyvin vähän lämpötilan nostamisessa, joten keramiikkaa voidaan käyttää korkeamman lämpötilan välein.
Muita sen käyttöä ovat katalyyttinä, muiden litiumyhdisteiden, kuten hitsauselektrodien, valmistuksessa luminesoivissa maalimuodoissa, lakkoissa ja väriaineissa sekä alumiinielektrolyyttisessä tuotannossa.
Se on hyödyllinen nopeamman sementtiasetuksen luomisessa ja lisää laattaliimaa, jotta ne voidaan korjata lyhyessä ajassa.
 Kirjoittaja: Capri23auto. Lähde: Pixabay.
Kirjoittaja: Capri23auto. Lähde: Pixabay. Viitteet
- Cai, W. et al. (2018). SO: n poistaminen42- Li2Yhteistyö3 uudelleenkiteyttämällä NA: ssa2Yhteistyö3. Kristallit 2018, 8, 19. MDPI toipui.com.
- Gadikota, G. (2017). Morfologisten ja kiderakenteiden muutosten yhdistäminen litiumhydroksidimonohydraatin muuntamisen aikana litiumkarbonaatiksi käyttämällä monimuotoisia röntgensirontamittauksia. Mineraalit 2017, 7, 169. MDPI toipui.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Litiumkarbonaatti. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Neljäs painos. John Wiley & Sons.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Vch verlagsgellschaft mbh.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- « Sisäiset ja ulkoiset konjugoituja kulmia esimerkkejä, harjoituksia
- .Steariinihappo (CH3 (CH2) 16COOH) rakenne, ominaisuudet, käyttää »

