Kaliumsyanidi (KCN) -ominaisuudet, käytöt, rakenteet, riskit,

- 3251
- 97
- Mr. Clifford Kshlerin
Hän Kaliumsyanidi Se on epäorgaaninen yhdiste, jonka muodostaa ionikalium k+ ja CN -syanidi -ioni-. Sen kemiallinen kaava on KCN. Se on kiteinen valkoinen kiinteä, erittäin myrkyllinen.
KCN on hyvin liukoinen veteen ja liuottaessa sitä hydrolysoituu muodostaen syanhydridihappoa tai HCN -vetysyanidia, joka on myös erittäin myrkyllinen. Kaliumsyanidi voi muodostaa yhdistelmäsuoloja kullalla ja hopealla, joten sitä käytettiin näiden jalometallien purkamiseen tietyistä mineraaleista.
 Kiinteä KCN -kaliumsyanidi. Morienus (Lähettäjä DE: Benutzer: BXXXD Lähettäjä: Wiki) [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons.
Kiinteä KCN -kaliumsyanidi. Morienus (Lähettäjä DE: Benutzer: BXXXD Lähettäjä: Wiki) [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons. KCN: tä käytetään peittämään halpoja metalleja kullalla ja hopealla sähkökemiallisen prosessin kautta, toisin sanoen menetelmä, jolla sähkövirta johdetaan liuoksen läpi, joka sisältää suolaa, joka koostuu jalomatista, syanidista ja kaliumista.
Kaliumsyanidi, koska se sisältää syanidia. Sitä ei tule koskaan hylätä ympäristölle, koska se on myös erittäin myrkyllinen useimmille eläimille ja kasveille.
Menetelmiä, joissa käytetään yleisiä leviä.
[TOC]
Rakenne
KCN on ioninen yhdiste, joka on muodostettu kaliumkationilla K+ ja syanidianionin CN-. Tässä hiiliatomi on kytketty typpiatomiin kolminkertaisen kovalenttisen sidoksen kautta.
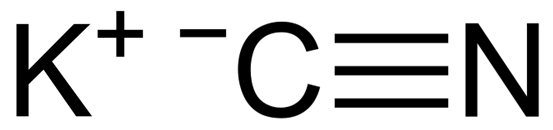 KCN: n kaliumsyanidikemiallinen rakenne. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
KCN: n kaliumsyanidikemiallinen rakenne. Capacio [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Kiinteässä kaliumsyanidissa CN -anionissa- Se voi pyöriä vapaasti sen mukaan, mikä käyttäytyy kuin pallomainen anionin, seurauksena KCN -kidellä on kuutiometriä, joka on samanlainen kuin KCL -kaliumkloridi.
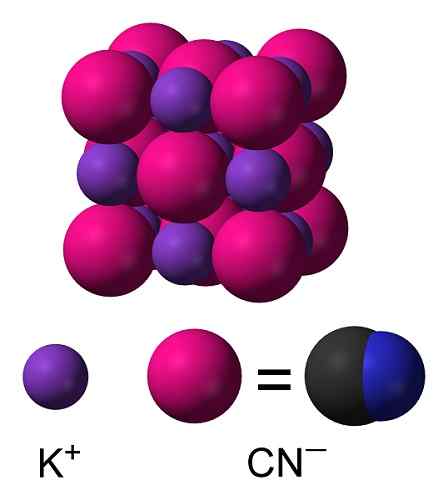 KCN -kiderakenne. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
KCN -kiderakenne. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Nimikkeistö
- Kaliumsyanidi
- Kaliumsyanidi
- Cianopotasio
Ominaisuudet
Fyysinen tila
Valkoinen kiteinen kiinteä. Kuutiokiteet.
Molekyylipaino
65 116 g/mol.
Sulamispiste
634,5 ° C
Se voi palvella sinua: alumiinisulfaatti (Al2 (SO4) 3)Kiehumispiste
1625 ° C.
Tiheys
1,55 g/cm3 20 ° C: ssa.
Liukoisuus
Hyvin liukoinen veteen: 716 g/l 25 ° C: ssa ja 100 g/100 ml vettä 80 ° C: ssa. Pieni liukoinen metanolissa: 4,91 g/100 g metanolia 19,5 ° C: ssa. Hyvin vähän liukoista etanoliin: 0,57 g/100 g etanolia 19,5 ° C: ssa.
PHE
Vesipitoisen 6,5 g: n KCN: n 1 litran vettä on pH 11,0.
Hydrolyysivakio
KCN on hyvin liukoinen veteen. Kun syanidi -ionin CN on vapaa- joka vie protonin H+ vettä HCN: n syanhydric -hapon muodostamiseksi ja OH -ionin vapauttaminen--
CN- + H2O → HCN + OH-
Hydrolyysivakio osoittaa suuntauksen, jolla mainittu reaktio suoritetaan.
K -k -h = 2,54 x 10-5
KCN -vesiliuokset vapauttavat HCN -vetysyanidiympäristön, kun ne kuumenevat 80 ° C.
Kemialliset ominaisuudet
Se ei ole syttyväx, K -upotusoksidi2O ja hiilimonoksidi.
KCN reagoi kultasuolojen kanssa, jotka muodostavat kalium aurocianuro kau (CN)2 ja kalium auriikicouro kau (CN)4. Nämä ovat komplekseja värittömiä suoloja. Hopeametalli AG: llä KCN muodostaa kalium argentosyanidi Kag (CN)2.
KCN -syanidi -ioni reagoi tiettyjen orgaanisten yhdisteiden kanssa, joissa on halogeenia (kuten kloori tai bromi) ja vie näiden paikan. Esimerkiksi, se reagoi bromoetikkahappojen kanssa syaanienetikkahapon antamiseksi.
Muut ominaisuudet
Se on hygroskooppinen, imee ympäristön kosteuden.
Sillä on pehmeä katkera mantelit, mutta kaikki ihmiset eivät havaitse sitä.
Saada
KCN valmistetaan KOH -kaliumhydroksidireaktiolla vesiliuoksessa HCN -vetysyanidin kanssa. Kaliumferrosyanidi k saadaan myös kuumentamalla4Usko (CN)6-
K -k -4Usko (CN)6 → 4 kcn + 2 c + n2↑ + usko
Käytä metallielektrodissa
Sitä käytetään peittämään pieniä arvokkaita metalleja kullalla ja hopealla. Se on elektrolyyttinen prosessi, ts. Sähkö johdetaan vesiliuoksen läpi sopivilla suoloilla.
Se voi palvella sinua: rikkitrioksidi (SO3): rakenne, ominaisuudet, riskit, käyttötarkoituksetHopea
Käytetään kalium argentosyanidi kag (CN)2 Pinnoittelu halvemmalla metallilla (AG).
Nämä asetetaan kaliumkagin (CN) vesiliuokseen2, Missä positiivinen anodi tai napa on puhdas hopeapalkki (AG) ja katodi tai negatiivinen napa on halpa metalli, joka halutut hopeaa.
Kun sähkövirta kulkee liuoksen läpi, hopea kerrostuu toiseen metalliin. Kun syanidisuoloja käytetään, hopeakerros on kerrostettu hienompaan, kompaktimaisempaan ja tarttuvaan tapaan kuin muiden yhdisteiden liuoksiin.
 Jotkut koruesineet peitetään hopealla KCN -suoloilla. Kirjoittaja: StockSnap. Lähde: Pixabay.
Jotkut koruesineet peitetään hopealla KCN -suoloilla. Kirjoittaja: StockSnap. Lähde: Pixabay. Kulta
Samoin kullan (AU) tapauksessa kalium -aurosyanidi Kau (CN)2 ja kalium auriikicouro kau (CN)4 Muita metalleja käytetään elektrolyyttisesti ruskeaksi.
 Sähköliittimet, jotka on päällystetty kullalla mahdollisesti KCN -suoloja käyttämällä. CJP24 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Sähköliittimet, jotka on päällystetty kullalla mahdollisesti KCN -suoloja käyttämällä. CJP24 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Muut käyttötarkoitukset
Joitakin muita kaliumsyanidin käyttötarkoituksia mainitaan alla.
- Nitroratioterästen kovettumisen teollisuusprosessia varten (typen lisäys).
- Metallinpuhdistukseen.
- Tulostus- ja valokuvausprosesseissa.
- Aikaisemmin sitä käytettiin kullan ja hopean uuttamiseen niitä sisältävistä mineraaleista, mutta sitten se korvattiin natrium -NACN -syanidilla, joka on halvempi, vaikkakin yhtä myrkyllinen.
- Hyönteismyrkkynä puiden, alusten, rautatieautojen ja varastojen kuristamiseen.
- Analyyttisen kemian reagenssina, toisin sanoen kemiallisen analyysin tekemiseen.
- Muiden kemiallisten yhdisteiden, kuten väriaineiden ja väriaineiden valmistamiseksi.
 Kultapoisto Etelä -Afrikassa vuonna 1903 käyttämällä KCN: tä ympäröivän ympäristön kuolevaisten pilaantumisessa. Argyll, John Douglas Sutherland Campbell, herttua, 1845-1914; Creswicke, Louis [ei rajoituksia]. Lähde: Wikimedia Commons.
Kultapoisto Etelä -Afrikassa vuonna 1903 käyttämällä KCN: tä ympäröivän ympäristön kuolevaisten pilaantumisessa. Argyll, John Douglas Sutherland Campbell, herttua, 1845-1914; Creswicke, Louis [ei rajoituksia]. Lähde: Wikimedia Commons. Riskejä
KCN on erittäin myrkyllinen yhdiste eläimille ja useimmille kasveille ja mikro -organismeille. Luokitellaan erittäin myrkylliseksi. Se on edelleen tappava hyvin pienissä määrissä.
Se voi palvella sinua: nikkelikloridi (NICL2): rakenne, ominaisuudet, hankkiminen, käyttöSen haitallista vaikutusta voi tapahtua hengittämällä, kosketuksella ihoon tai silmiin tai nielemiseen. Estää monia metabolisia prosesseja, erityisesti veriproteiineja, jotka osallistuvat hapen kuljetukseen, kuten hemoglobiiniin.
Se vaikuttaa elimiin tai järjestelmiin, jotka ovat herkempiä hapen puutteeseen, kuten keskushermostoon (aivoihin), sydän- ja verisuonijärjestelmään (sydän- ja verisuonet) ja keuhkoihin.
 Kaliumsyanidi on myrkky. Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay.
Kaliumsyanidi on myrkky. Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay. Toimintamekanismi
KCN häiritsee kehon kykyä käyttää happea.
Syanidi -ioni CN- KCN: stä on suuri affiniteetti rauta -uskoon3+, Mikä tarkoittaa, että kun syanidi imee, se reagoi nopeasti uskon kanssa3+ Veri ja kudokset.
Tällä tavoin se estää solujen hengityksen, jotka menevät hapen puutteeseen, koska vaikka he yrittävät hengittää, he eivät voi käyttää sitä.
Sitä esiintyy sitten hipperapnean (hengitysjousitus) ja päänsärkyn välinen tila ja lopulta kuolema hengitystilan pidätyksellä.
Lisäriskejä
Lämmittäessä se tuottaa erittäin myrkyllisiä kaasuja, kuten HCN, typpioksiditx, K -upotusoksidi2O ja hiilimonoksidi.
Kun olet kosketuksissa HCN -kosteuden kanssa, joka on erittäin syttyvä ja erittäin myrkyllinen.
KCN on myös hyvin myrkyllinen vesieliöille. Sitä ei tule koskaan hylätä ympäristöön, koska veden pilaantuminen voi tapahtua silloin, kun he juovat eläimiä ja asuttavat kaloja.
On kuitenkin bakteereja, jotka tuottavat syanidia, kuten Chromobacterium violaceum Ja jotkut Pseudomonas.
Viimeisimmät tutkimukset
Tietyt tutkijat havaitsivat, että vihreät levät Chlorella vulgaris Sitä voidaan käyttää saastuneiden vesien hoitamiseen KCN -kaliumsyanidilla alhaisissa pitoisuuksissa.
Levät pystyivät poistamaan KCN: n tehokkaasti, koska tämä pieninä määrinä stimuloi levien kasvua, koska se aktivoi sisäisen mekanismin vastustamaan KCN: n toksisuutta.
Tämä tarkoittaa, että levät Chlorella vulgaris Sillä on potentiaali poistaa syanidi ja että syanidikontaminaation biologiseen käsittelyyn liittyvä tehokas menetelmä voitaisiin suunnitella tällä.
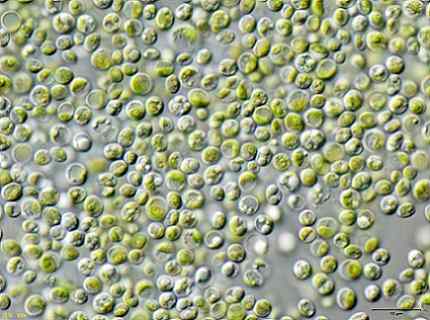 Leväkuva Chlorella vulgaris havaittu mikroskoopissa. JA: Käyttäjä: neon / käyttäjä: neon_ja [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Leväkuva Chlorella vulgaris havaittu mikroskoopissa. JA: Käyttäjä: neon / käyttäjä: neon_ja [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Kaliumsyanidi. Kansallinen bioteknologiatietojen keskus. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Kopakka, r.W -. (2009). Kemiallisen sodankäynnin agenttien uhkia villieläimille. Kemiallisten sodankäynnin agenttien toksikologian käsikirjassa. ScienEdirect.com.
- Liu, q. (2017). Kaliumsyanidin poistamisen arviointi ja sen myrkyllisyys vihreissä leväissä (Chlorella vulgaris-A. Härkäympäristö Contam Toxicol. 2018; 100 (2): 228-233. NCBI toipunut.Nlm.NIH.Hallitus.
- Kansallinen työturvallisuus- ja terveysinstituutti (NIOSH). (2011). Kaliumsyanidi: systeeminen aine. CDC palautettu.Hallitus.
- Alvarado, L.J -. et al. (2014). Riboswitch -löytö, rakenne ja toiminto. Urasiilin synteesi. Entsymologian menetelmissä. ScienEdirect.com.
- « Natrium -kolmifosfaatti (NA5P3O10) rakenne, ominaisuudet, käytöt, isku
- Koska olen hyvin uninen? 9 syytä ja ratkaisua »

